La corteza terrestre, al igual que el resto del sistema solar, está constituida por una variedad limitada de elementos químicos.
Los elementos químicos están formados por átomos, que en sus núcleos contienen partículas de masa significativa y carga eléctrica positiva, denominadas protones. Los núcleos atómicos están rodeados por electrones, partículas de masa insignificante en comparación con la de los protones, de carga eléctrica negativa y en movimiento orbital alrededor de los núcleos.
El tamaño de los átomos se mide en Ångström (1 Å = 10-10 m). El radio de ellos varía desde 0,48 Å (átomo de Hidrógeno), hasta 2,62 Å (átomo de Cesio). Es un parámetro que interviene a la hora de producirse combinaciones entre ellos.
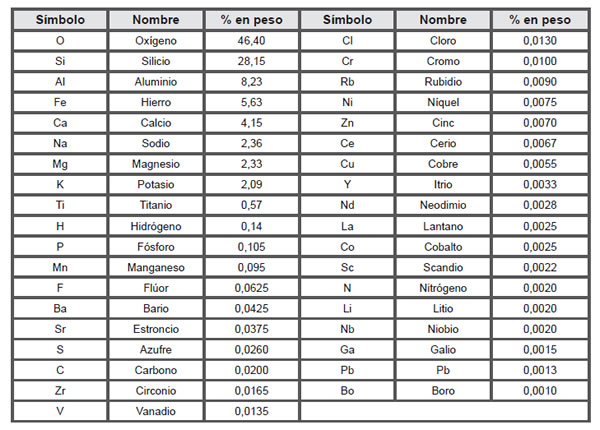
El número de protones de un átomo, denominado número atómico, determina la especie química a la que pertenece. Se conocen 103 elementos químicos, aunque muchos son poco abundantes. Son 37 los que en la corteza terrestre tienen una abundancia en porciento en peso superior a una milésima del total (Tabla 3.1).

Tabla 3.1. Elementos más abundantes en la corteza terrestre.
El análisis de la tabla permite apreciar que aún entre los 37 más abundantes hay algunos poco familiares, ejemplo Circonio, Cerio, Itrio, Escandio y Galio. También puede mencionarse que otros que no están representados en la tabla, son conocidos por el uso en productos de interés comercial o industrial, ejemplo Uranio, Estaño, Arsénico, Molibdeno, Iodo, Antimonio, Bismuto, Mercurio, Plata, Platino y Oro. Lo anterior previene sobre el accionar de procesos naturales que concentran los elementos de menor abundancia, para que constituyan menas explotables por el hombre. Mena es un término de uso en minería, que se refiere a materiales que constituyen yacimientos (uno o varios minerales asociados), de los que se puede extraer un elemento químico para su aprovechamiento. Ejemplos, los minerales blenda (ZnS) y galena (PbS), comúnmente asociados en vetas y son mena de Cinc y de Plomo, respectivamente.
Otra partícula, que se dispone en los núcleos atómicos, es denominada neutrón, la cual aporta igual cantidad de masa que un protón, pero carece de carga eléctrica. La diferente cantidad de neutrones en un mismo elemento químico genera variedades másicas, denominadas isótopos.
El estudio de los isótopos de algunos elementos tiene utilidad en geología. Su aplicación se ha incrementado, tanto como para dar entidad a una especialidad, denominada geología isotópica, que entre otras cuestiones se encarga de medir el tiempo geológico.
Interesa destacar que la complejidad que se observa en la superficie de la Tierra es aparente, ya que la corteza terrestre continental está integrada mayoritariamente por 11 elementos químicos y el resto participa cada uno en cantidades menores al 0,1% en peso del total.
Teniendo en cuenta la abundancia de los elementos, el análisis químico rutinario de rocas determina primero la participación de los denominados elementos mayoritarios, que se expresa en porciento en peso de los óxidos de 10 elementos (Tabla 3.2).
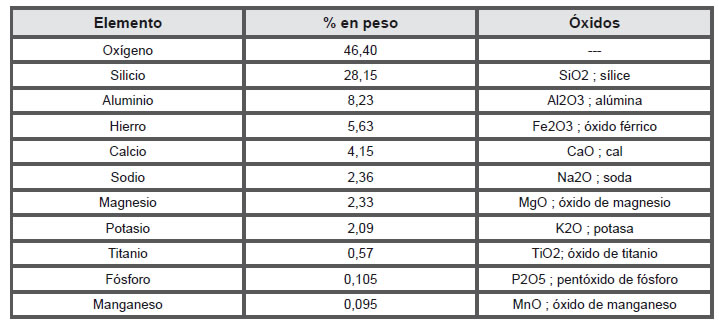
Tabla 3.2. Elementos mayoritarios y sus óxidos.
Otros elementos químicos, aunque presentes en cantidades menores, son importantes ya sea por ciertas cualidades que les confieren valor económico, o por ser trazadores de procesos geológicos y ambientales. Son denominados elementos minoritarios o trazas (Bario, Estroncio, Circonio, Vanadio, Cromo, Rubidio, Níquel, Cinc, Cobre, Cobalto, Litio, Niobio, etc.). Sus cantidades en los análisis químicos son expresadas en partes por millón (ppm).
Entre los minoritarios se destaca el grupo de las tierras raras (Lantano, Cerio, Praseodimio, Neodimio, Samario, Europio, Gadolinio, Terbio, Disprosio, Holmio, Erbio, Tulio, Iterbio y Lutecio). La determinación cuantitativa precisa de las microcantidades de ellos, posibilita a los geoquímicos la caracterización de rocas ígneas de diferentes orígenes.
En la corteza terrestre los átomos de los elementos químicos están combinados entre sí formando minerales. La posibilidad de combinación de los diferentes elementos es función principalmente de la carga eléctrica al estado iónico (positiva o negativa) y del tamaño de sus átomos. Las diversas combinaciones posibles entre elementos responden a una organización interna regular que se denomina estado cristalino.
El estado sólido de la materia natural es ampliamente dominado por el estado cristalino, a excepción de menores cantidades de vidrio volcánico y algunos mineraloides.
En el estado cristalino los átomos se disponen ordenadamente según un retículo, que repetido en tres dimensiones le confiere a un determinado mineral una fórmula química representativa y un conjunto de propiedades físicas constantes. Las propiedades físicas incluyen peso específico, color, brillo, dureza, color de la raya, clivaje, forma de los cristales individuales y propiedades ópticas. En el caso de la combinación entre átomos de Cloro (Cl-) y de Sodio (Na+), el producto es el Cloruro de Sodio (NaCl; Halita), la sal de mesa, que cristaliza en cubos (Fig. 3.1).
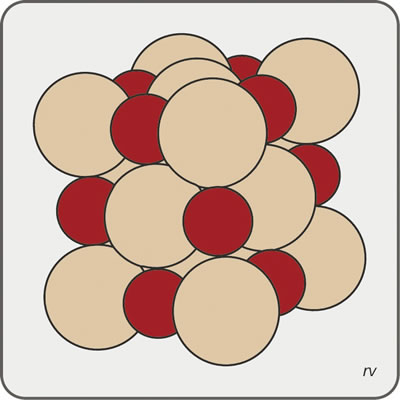
Figura 3.1. Ordenamiento de átomos de cloro (esferas grandes, castaño claro) y de sodio (esferas pequeñas, castaño rojizo), determinando la forma de un cubo.
Para el diagnóstico de una especie mineral a nivel de muestra de mano y en el campo, el geólogo se basa en sus propiedades físicas.
El peso específico, aunque en el terreno no lo pueda establecer con precisión, puede estimarlo y ser de utilidad, junto a la evaluación de otras propiedades. Por ejemplo, la Baritina es un sulfato de bario (BaSO4) de alto peso específico (4,5 g/cm3).
El color puede orientar en la determinación. Por ejemplo el color rosado de la Rodocrosita, un carbonato de manganeso (MnCO3). El brillo de un mineral puede ser metálico, adamantino, sedoso, etc. y también es tenido en cuenta para identificar un mineral.
La dureza es de gran utilidad en la diagnosis mineral y hay estimación relativa según la escala de Mohs (Fig. 3.2), una decena de minerales ordenados según dureza creciente que incluye Talco (dureza 1), Yeso (2), Calcita (3), Fluorita (4), Apatita (5), Ortosa (6), Cuarzo (7), Topacio (8), Corindón (9) y Diamante (10). En el terreno, para la diagnosis mineral es de utilidad conocer que la dureza de nuestras uñas alcanza para rayar al Yeso (dureza 2) pero no a la Calcita (dureza 3). También que la dureza de una punta de acero raya la Ortosa (dureza 6) pero no al Cuarzo (dureza 7).

Figura 3.2. Minerales de la Escala de Mohs.
El color de la raya se obtiene utilizando al mineral como un lápiz en la superficie de un cerámico blanco. Por ejemplo, la raya de la Blenda (ZnS) es de color blanco a amarillenta o castaño y la de la Galena (PbS) es gris plomo, lo que ayuda a distinguir entre esos dos sulfuros de interés económico que corrientemente van asociados.
El clivaje mineral es la propiedad de un mineral de partirse según planos característicos, relacionados con el ordenamiento atómico. Por ejemplo es notorio el clivaje romboédrico de la Calcita (CaCO3).
Los cristales individuales, si hay expresión visible, pueden ser aciculares, prismáticos, cúbicos, romboédricos, etc. Algunas especies que frecuentemente ofrecen cristales visibles son Halita (cubos), Cuarzo (prismas piramidados), Calcita (romboedros), Fluorita (octaedros) y Ortosa (prismas).
La cristalografía se encarga del estudio de las formas posibles de organización cristalina en los minerales. La materia prima son los cristales. Los elementos de simetría para determinar las características de un cristal son plano de simetría, eje de simetría y centro de simetría. Todos los cristales tienen una determinada simetría, que se puede establecer por la disposición de sus caras. El estudio sistemático establece que hay seis sistemas cristalinos posibles, denominados cúbico o isodiamétrico; hexagonal; tetragonal; rómbico; monoclínico y triclínico (Fig. 3.3).
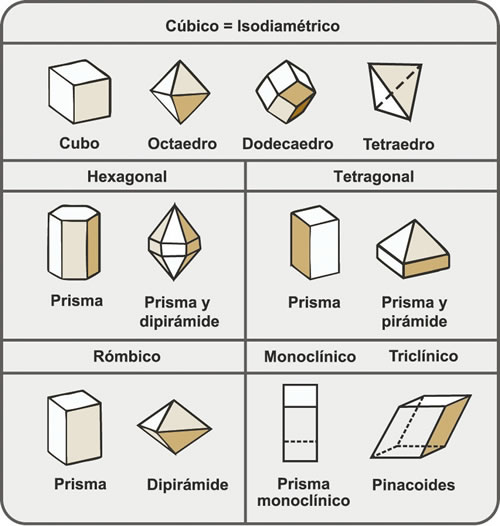
Figura 3.3. Sistemas cristalinos y formas comunes.
Minerales comunes que cristalizan en el sistema cúbico son las sales Halita (NaCl) cloruro de sodio y Silvina (KCl) cloruro de potasio. La Fluorita (CaF2) fluoruro de calcio, utilizada como fundente en la industria del vidrio y del hierro. La Galena (PbS) sulfuro de plomo y Blenda (ZnS) sulfuro de cinc, son menas respectivas de plomo y cinc. También la Pirita (FeS2) sulfuro de hierro, que es un mineral accesorio frecuente en rocas graníticas.
Minerales comunes que cristalizan en el sistema hexagonal son el Cuarzo (SiO2 ), muy importante componente de rocas ígneas. El Berilo, un aluminosilicato de berilio, (Si6O18Be3Al2 ), apreciado como gema preciosa, con variedades de color verde (esmeralda) y azul-verdoso (aguamarina). La Molibdenita (MoS2 ) sulfuro de molibdeno, utilizado en aleaciones metálicas y como aditivo en lubricantes. La Calcita (CaCO3 ) carbonato de calcio, constituye las calizas y mármoles, utilizados como rocas de construcción y en la fabricación de cales y cementos.
Minerales comunes que cristalizan en el sistema tetragonal son el Circón (ZrSiO4 ) y Rutilo (TiO2), frecuentes en pequeñas cantidades en rocas graníticas.
Minerales comunes que cristalizan en el sistema rómbico son el Azufre nativo (S). El sulfato de bario Baritina (BaSO4) y el silicato Olivino [SiO4(Mg, Fe)2 ].
Minerales comunes que cristalizan en el sistema monoclínico son los silicatos formadores de rocas ígneas de los grupos de los Anfíboles y Piroxenos, el feldespato potásico Ortosa y la mica blanca Moscovita. También Talco y Yeso.
Minerales comunes que cristalizan en el sistema triclínico son los silicatos del grupo de las Plagioclasas, muy importantes como formadores de rocas ígneas.
Destacamos que cristalografía y mineralogía son importantes disciplinas auxiliares de la geología y tienen metodología propia de trabajo.
La mineralogía clasifica a los minerales según clases, en las que el parámetro tenido en cuenta es la composición química, como elementos nativos, óxidos, carbonatos, sulfatos y silicatos, entre otras.
Los silicatos son la clase de mayor importancia en lo que hace a variedad de formas minerales e importancia en la integración de rocas de la corteza terrestre.
Figura 3.4. Tetraedro SiO4. El átomo de Silicio representado por la pequeña esfera castaño rojizo, ocupa el centro de la figura. Los átomos de Oxígeno (translúcidos) se acomodan a su alrededor, en los vértices del imaginario tetraedro.
La unidad elemental de los silicatos está constituida por un átomo de Silicio (Si+4), rodeado por cuatro átomos de Oxígeno (O-2), según una figura en la que el átomo de Silicio se dispone en el centro de los tetraedros y los de Oxígeno en los vértices de un imaginario tetraedro. Es conocida como tetraedro (SiO4), estructura de carga eléctrica positiva +4 (Fig. 3.4).
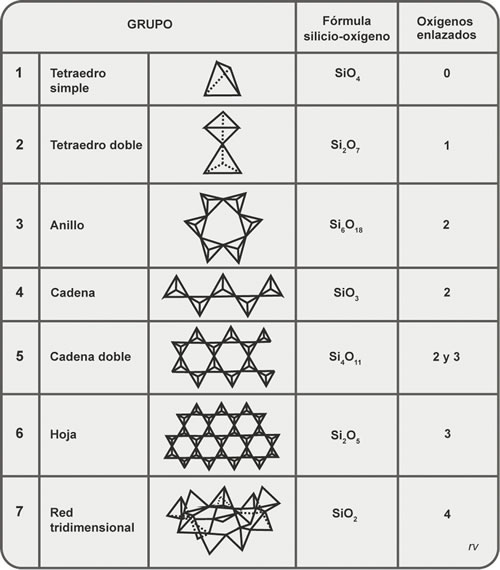
Figura 3.5. Relación entre tetraedros SiO4 en los siete grupos posibles de silicatos.
Los tetraedros (SiO4 ) pueden mantenerse aislados o unirse de varias formas entre sí (Fig. 3.5). Además, en todos los casos, alcanzan neutralidad eléctrica combinando elementos de carga iónica positiva.
La estructura más sencilla es la del grupo denominado nesosilicatos, en la que los tetraedros se mantienen independientes entre sí, consiguiendo estabilidad por combinación con elementos de carga iónica positiva. Son ejemplos los minerales llamados Olivina y Circón.
Estructuras más complejas se producen por la reunión de dos o más tetraedros SiO4. Si lo hacen de a dos, compartiendo uno de sus átomos de Oxígeno, forman un grupo denominado sorosilicatos, del que es ejemplo el Epidoto.
La unión de tres o más tetraedros SiO4 en forma de anillo, compartiendo cada uno dos átomos de Oxígeno, corresponde al grupo denominado ciclosilicatos. Son ejemplos los minerales denominados Berilo y Turmalina, en los que se forman anillos hexagonales.
En el grupo de los inosilicatos la unión de tetraedros SiO4 da lugar a cadenas. Hay un subgrupo donde las cadenas son simples, en las que se comparten dos átomos de Oxígeno (ejemplo Piroxenos). Un segundo subgrupo forma cadenas dobles, donde hay posiciones en las que se comparten dos átomos de Oxígeno y otras donde se comparten tres átomos de Oxígeno (ejemplo Anfíboles).
El grupo de silicatos en el que todos los tetraedros SiO4 se unen compartiendo tres átomos de Oxígeno recibe el nombre de filosilicatos. Es la estructura hojosa de las micas Biotita (mica negra) y Moscovita (mica blanca).
Finalmente, corresponde al grupo de los tectosilicatos la estructura resultante de la unión de los tetraedros SiO4 en redes tridimensionales, donde se comparten los cuatro átomos de Oxígeno. Incluye a los minerales más abundantes en las rocas comunes de la corteza terrestre, como son el Cuarzo y los Feldespatos.
Una menor cantidad de materiales componentes de la corteza terrestre se caracteriza por no responder a una fórmula química definida y no evidenciar rasgos de cristalinidad. Estas sustancias amorfas naturales se denominan mineraloides.
Los mineraloides se forman a baja temperatura y presión y generalmente son producidos por la meteorización de materiales en la superficie terrestre. Son ejemplos la Limonita [FeO(OH).nH2O + Fe2O3.nH2O] y el Ópalo [SiO2.nH2O].