Con el agregado de mayor número de componentes se incrementa la dificultad para visualizar las variables del sistema. Idealmente debería haber una dimensión para cada variable, pero estamos limitados a gráficos en dos dimensiones. Para los sistemas de dos componentes usamos diagramas isobáricos T – X, los cuales son secciones isobáricas de diagramas T – P - X tridimensionales. Cuando nos movemos con sistemas de tres componentes, elegimos diagramas T – P – X tridimensionales o debemos explorar otros caminos para poder simplificarlos a dos dimensiones. Aquí se analizarán tres sistemas relativamente simples, que proporcionan una variedad de situaciones, para ilustrar los procesos físicos y las técnicas analíticas. En los sistemas cuaternarios la complejidad aumenta y es dificultoso su expresión en un plano.
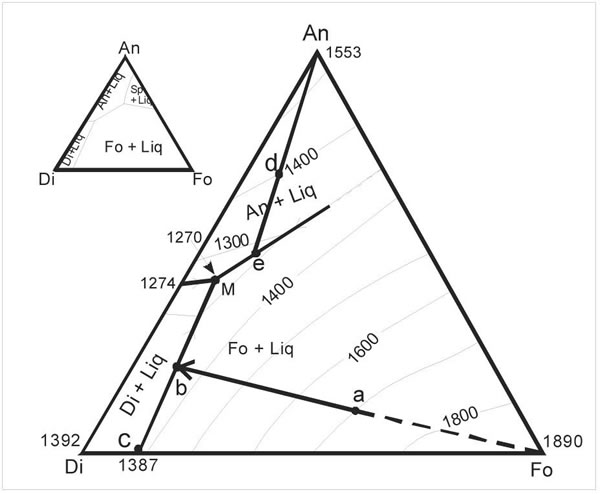
Entre los sistemas de tres componentes veremos el sistema eutéctico diópsido (Di), anortita (An) ver (Fig. 6-7), al que se le agregara un tercer componente forsterita (Fo – Mg2SiO4). Como el olivino se encuentra en muchos basaltos, el sistema Di-An-Fo se aproxima al modelo de los magmas basálticos. Sabemos que hay solución sólida en los sistemas basálticos naturales, por el intercambio Fe – Mg, que aquí no tendremos en cuenta. El sistema Di-An-Fo es representado por un triángulo, con cada componente en un vértice del mismo, al que se le agregan las temperaturas, quedando el sistema integrado por tres eutécticos binarios, uno sobre cada lado del triángulo (Fig. 7-1). Estos sistemas eutéctios binarios son: Di-An, Di-Fo y An-Fo y no se considera el campo de la espinela. Asimismo forma parte del tetraedro diópsido-forsterita-albita-anortita.

Figura 7-1. Diagrama isobárico (0,1 MPa) con las temperaturas del sistema Diópsido-Anortita-Forsterita (Bowen 1915).
Cualquiera sea el campo donde se origina la cristalización, todos convergen en el punto eutéctico M, que es donde cristalizan las tres fases y corresponde a la temperatura más baja de la superficie del liquidus (Fig. 7-1). Los sistemas binarios se definen mediante las curvas cotecticas y las flechas indican el sentido de su evolución (descenso de Tº), en dirección al mínimo eutéctico M.
Las curvas cotecticas separan las superficies de los líquidos en tres áreas, con puntos eutécticos binarios separados y cada sección de liquidus coexiste con diferentes sólidos.
Las 3 áreas nombradas son: Fo + liq.; Di + liq.; An + liq. Usando la regla de las fases se puede analizar el comportamiento de los fundidos del sistema ternario.
Para un líquido de composición a (Fig. 7-1) de Di36An10Fo54 en peso%, que está por encima de 1700ºC, solo hay fundido, porque C=3; f=1, la regla isobárica de las fases a 0,1 MPa (presión atmosférica) será V=3 (V=F-C+1). Por enfriamiento desde a el sistema se encuentra con el liquidus de la Fo + liquido y la Fo comienza a cristalizar. Ahora f = 2 y V = 2. Como la temperatura está descendiendo y la Fo continúa cristalizando, el líquido se deprime en dicho componente. Así la composición del líquido cambia en la dirección marcada por la flecha, que se expresa uniendo el vértice de la Fo, con el punto a, y hasta el punto b. Esto involucra una reacción continua del tipo:
Líquido 1 = Fo + Líquido2
Con el enfriamiento el nuevo líquido 2 va incrementado sus contenidos en Ca y Al, por pérdida de Mg2SiO4 que forman olivino.
A cualquier temperatura, las cantidades relativas de líquido y Fo, pueden ser calculadas usando la regla de Lever y los 3 puntos alineados representan la composición del líquido.
Cuando el líquido se enfría hasta b (1350ºC), comienza a formarse Di, junto a Fo y líquido. Ahora hay 3 fases y V = 1. Los sólidos en este sistema son los que fijan la composición del líquido, que coexiste con los dos sólidos y determina la temperatura de la curva cotectica entre el sistema eutéctico binario Di-Fo y el eutéctico ternario M, por mayor enfriamiento.
Determinar las cantidades relativas de Di, Fo y líquido, a cualquier temperatura, es posible pero más complicado que en los sistemas de dos fases.
Cuando el líquido alcanza el punto M, a 1270ºC, cristalizan simultáneamente, desde el líquido, Fo-Di-An. Ahora V = 3 – 4 + 1 = 0, tenemos un punto invariante a una Tº y P fija, con la composición de todas las fases y el líquido. La temperatura se mantendrá constante hasta que las tres fases sólidas hayan cristalizado totalmente, o sea que se haya agotado la fase líquida, recién entonces la temperatura podrá seguir descendiendo:
Líquido > Di + An + Fo
Por debajo de 1270ºC, las 3 fases sólidas coexisten con 1 grado de libertad. El patrón a > b > M, es llamada curva evolutiva del líquido o curva descendente del líquido.
El patrón descrito se puede aplicar a la composición de otros líquidos del sistema. Si aplicamos la evolución al punto d, la anortita comenzará a cristalizar a 1400ºC. La composición del líquido se moverá siguiendo la trayectoria marcada desde el vértice An con d hasta intersectar la curva en e, donde comienza a cristalizar Fo definiendo la curva cotectica que se continúa hasta M.
Como no hay solución sólida el patrón de evolución del líquido en la cristalización fraccionada es similar a la cristalización en equilibrio. La remoción de fases tempranas, afecta la composición final del basalto cristalizado. Si las fases tempranas son removidas por fraccionación (asentamiento o flotación), los líquidos se separarán desde los cristalizados en cualquier punto de evolución de la curva líquida, y la roca se formará por cristalización en equilibrio desde un líquido derivado, que evoluciona desde el punto de separación, con una nueva composición global. La roca final debe tener la composición global del líquido en el punto M (43% plagioclasa, 50% clinopiroxeno y 7% de olivino en peso).
Es la inversa de la cristalización equilibrio. La fusión de Di-Fo-An, producirá un primer fundido de composición M. El líquido remanente tendrá una reacción discontinua, en reversa hasta que una fase es consumida, lo que depende de la composición global del sistema y estará determinada por la curva cotectica del líquido que parte desde M. Si la Fo se consume primero, por ejemplo, el líquido seguirá la curva contectica Di-An.
El primer fundido de una mezcla de Di-An-Fo, se producirá en el eutéctico M. Suponiendo que la composición del fundido es producida por reacción univariante, en reversa y extraído en pequeños incrementos (fusión fraccionada), hasta que una fase es consumida. Si comenzamos con la composición global a, la anortita será la primera en consumirse y el sistema binario sólido remanente será Fo + Di, que no alcanzará la fusión hasta que la temperatura alcance los 1270 - 1387ºC (Tº del eutectico binario Fo-Di). La fusión fraccionada invariante binaria se producirá desde la composición eutectica Fo-Di a temperatura constante de 1387ºC, hasta que el diópsido se consuma. El sólido remanente será Fo, que no funde hasta 1890ºC. Así la fusión parcial tendrá lugar en tres episodios separados. O también puede ocurrir en un único evento, involucrando fusión en equilibrio hasta que el fundido es removido desde los cristales residuales en algún punto de la evolución continua del líquido. La extracción producirá un fundido, con una composición global igual a la composición del líquido. Así la cristalización fraccionada puede dar magmas derivados que varían según el porcentaje de fusión parcial de la roca fuente.
El sistema Forsterita-Anortita-Sílice (Fo-An-SiO2) de la Fig. 7-2, es combinación del sistema eutéctico binario Di-An (Fig. 6-3), el sistema peritectico binario Fo-SiO2 y el sistema eutéctico binario An-SiO2, que tiene un mínimo del liquidus con el 52% peso de An a 1368ºC y que en conjunto definen el sistema ternario peritectico.
Dejando de lado la pequeña proporción de mezcla fundida a partir de las cuales cristalizan espinelas, las mezclas de anortita (An), forsterita (Fo) y sílice (SiO2), se trata como un sistema ternario peritéctico.
La presencia de anortita no afecta a la relación de reacción entre Fo y piroxeno (Px), excepto que la reacción se produce en un intervalo de temperaturas en mezclas fundidas cuyas composiciones varían a lo largo de la curva QR a medida que ocurre la reacción.
Un líquido de composición a original P por enfriamiento del liquidus, produce Fo a la largo de la curva PS, con el descenso de temperatura y considerando al sistema isobárico a 0,1 MPa, la condición de los tres componentes es para: V = 3 – 2 + 1 = 2 y la composición de líquido se mueve directamente desde el vértice Fo, por reacción continua, hasta S en la curva límite entre Fo y En, con V = 3 – 3 + 1 = 1, este líquido sigue ahora la curva peritectica SR de (Fo-SiO2) hasta el punto R, en la que la Fo entra en solución mientras se forma Px desde el fundido debido a la reacción con el líquido (cristalización por reacción) que se expresa por:
Líquido 1 + Fo = Líquido 2 + En
En R, punto invariante, la temperatura y la composición del líquido permanecen constantes mientras la Fo continúa disolviéndose y perdura la separación progresiva de An y Px. La reacción cesa cuando se agota la fase líquida y el producto final es una mezcla cristalina de Fo, An y Px.
A partir de un líquido T, el comportamiento es similar, excepto que la Fo y el líquido se agotan simultáneamente en R, quedando sólo Px y An. En el caso de un líquido original U, el curso es similar hasta S y R. La reacción en R, se termina por solución completa de la Fo, mientras queda algo de líquido, que evoluciona a lo largo de RE, con descenso de la temperatura, mientras cristaliza An y Px. En E aparece la cristalización eutéctica de An-Pxtridimita.
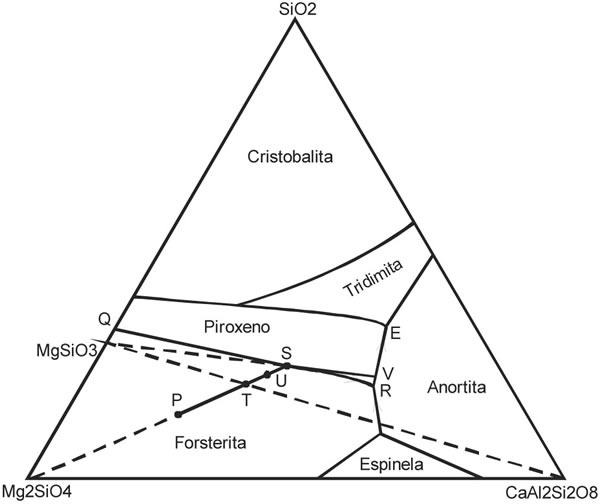
Fig. 7-2. Diagrama isobárico (a 0,1 MPa) del sistema Anortita-Forsterita-Sílice, mostrando las curvas cotéctica y peritéctica (Irvine 1975).
Un líquido original S, sigue un curso distinto, puesto que el Px es ahora la primera fase sólida que se forma. El fundido varía desde S hasta V con cristalización de Px y desde V hasta E con separación de Px y An. Nuevamente aparece en E la cristalización eutéctica (Px-An- SiO2) que continúa hasta que se agota el líquido.
Los líquidos T, U y S son todos derivados de la mezcla fundida P considerada originalmente. De esto se deduce que por cristalización fraccionada apropiada, se separarán cristales de Fo cuando el líquido alcanza las composiciones T, U o S, sucesivamente, que pueden dar lugar a rocas finales diferentes, a partir de una mezcla fundida untrabásica primitiva P. Los productos finales pueden ser: Ol-Px-An (gabro olivínico); Px-An (gabro o norita) y Px-An-SiO2 (gabro cuarcífero), que muestran un amplio grado de fraccionamiento. Asimismo se observa que el efecto de la cristalización fraccionada sobre la diferenciación aumenta, cuando un tercer componente (An) se añade al sistema binario que incluye un componente (Px) de fusión incongruente.
Volviendo a los derivados del fundido inicial P, si separa en S el olivino formado, se puede producir otra serie de mezclas fundidas SV que evolucionan formando Px-An.
Como es la reacción peritéctica, para la composición original P que tiene suficiente Fo para que no sea consumida por la reacción con el líquido remanente hasta el punto R en el que la An-Fo-Px y líquido producen un punto invariante (V = 3 – 4 + 1 = 0). En este punto invariante la siguiente reacción discontinua tiene lugar:
Líquido = Fo + Px + An
Este sistema permanece a 1270ºC hasta que el líquido es consumido por la reacción y la asociación final será de Fo-Px-An, en las proporciones relativas que se determinan por la regla de Lever.
Si algún mecanismo involucra la remoción de cristales de Fo, esto causa el cambio en la composición global y la migración de la composición del líquido fuera del campo de la Fo. Entonces no habrá Fo que participe de la reacción peritéctica y los líquidos siguen la curva QSV, produciendo directamente En hacia las curvas cotecticas de Px-An o Px-SiO2, dependiendo del contenido de An en el líquido.
El sistema diópsido-anortita-albita Di-Ab-An) es un ejemplo de sistema de tres componentes con solución sólida, aplicable a los basaltos. El sistema muestra completa miscibilidad entre dos componentes (Ab-An), mientras que el Di es insoluble en cualquiera de ellos. El sistema a presión atmosférica (0,1 MPa) está ilustrado en la Fig. 7-3, estos eutécticos binarios tienen el mínimo en Ab91Di9 a 1133ºC (Schairer y Yoder 1960). La línea cotectica desciende desde el eutéctico binario Di-An (1274ºC), reflejando la pendiente el liquidus Ab- An, que no es cuantitativa y sólo define el contorno del diagrama y cuando una solución sólida queda involucrada, se necesita determinar la composición de la plagioclasa que está en equilibrio con un líquido particular, para poder evaluar la evolución de la cristalización del fundido.
El análisis de la evolución cotéctica se inicia en el campo del diópsido. Al enfríar un fundido de composición a (1300ºC), el Di comienza a cristalizar como primera fase sólida. Cuando coexisten Di y líquido, la V = 2 (V=F-C+1) y Di cristaliza desde el líquido por la reacción continua:
Líquido1 = Di + Líquido2
La composición del líquido se mueve según la trayectoria determinada por la línea que se inicia en el vértice Di y pasa por a, hasta alcanzar la cotéctica en b a 1230ºC, en el que comienza a cristalizar An80, juntamente con el Di. Cuando se usan líneas complementarias, se determina en el diagrama la composición de las plagioclasas, considerando sólo la que coexiste con el Di y el líquido cotéctico.
Ahora con la cristalización continua de Di y Pl, la composición del líquido se mueve hacia c sobre la curva cotectica y la composición de la Pl se desplaza haciéndose más albítica. Con F = 3, C = 3 y V = 1, por la reacción continúa:
Líquido1 + Plagioclasa 1 > Líquido 2 + Di + Plagioclasa2
Como hay solución sólida, el líquido no alcanza el mínimo cotéctico y la cristalización termina, cuando la cristalización agota el líquido, como en el sistema de las plagioclasas. Cuando el líquido alcanza el punto c (1200ºC), la composición de la plagioclasa es de An50.
Veamos ahora el comportamiento de un líquido que esté en el campo de las plagioclasas, con composición d, el cual tiene Di15An55Ab30 (la composición final de la plagioclasa = 55/(55+30) = An65). En este caso el líquido se encuentra a 1420ºC y la plagioclasa que cristaliza tiene una composición An87. La composición no puede predecirse exactamente, sólo se puede estimar la composición de la plagioclasa, para f = 2 y V = 2, la cristalización sigue una línea de reacción sobre la superficie divariante del líquido:
Líquido1 + Plagioclasa1 = Líquido 2 + Plagioclasa2
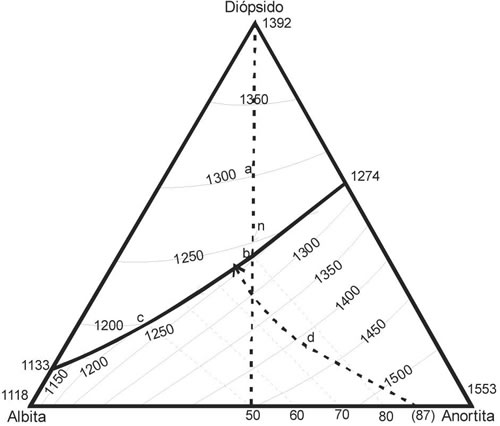
Fig. 7-3. Diagrama isobárico (0,1 MPa) Diópsido-Albita-Anortita, ilustrando la temperatura del liquidus (Morse 1994).
La composición del líquido evoluciona según el sólido que se va formando, pero la plagioclasa también se desplaza hacia la albita con el enfriamiento y crea un patrón curvo, que es ilustrado en la Fig. 7-3, donde varias líneas conectan las composiciones del líquido con las correspondientes plagioclasas que coexisten, todas las cuales pasan a través del punto d. El líquido alcanza el punto e, a 1220ºC, con plagioclasa An75 sobre la línea cotectica. En este punto, comienzan a cristalizar juntamente Di-Plag como fases cristalinas. Dado que la relación de la plagioclasa y el líquido es isobáricamente univariante, en un sistema isobárico de 3 componentes, solo una composición de plagioclasa puede coexistir con líquido y diópsido, a una temperatura dada. La cristalización continúa hasta que la composición de la plagioclasa alcanza el punto c en que se agota el líquido que corresponde a la composición original de la plagioclasa.
Como ya se vio la fusión en equilibrio es lo opuesto a la cristalización en equilibrio.
En la cristalización fraccionada, como involucra a una solución sólida, afecta a la composición del líquido final que cristaliza y permitiría continuar la cristalización a temperaturas más bajas, formado plagioclasa más albítica.
La fusión parcial, crea fundidos que difieren de la composición original del sistema ya que va extrayendo líquidos de menor punto de fusión, a lo largo de la evolución de la curva.
En los sistemas con más de tres componentes es dificultoso mostrar gráficamente todos los detalles de evolución de los líquidos en una superficie plana. En un sistema de cuatro componentes (cuaternario) es posible representar los cuatro componentes por los vértices de un tetraedro. Cada cara del tetraedro corresponde a un sistema ternario y los límites son proyectados desde las caras, al interior del tetraedro que representan los límites cuaternarios. Mientras los diagramas triangulares son divididos en áreas en las que los minerales individuales son las fases primarias (las primeras que cristalizan desde el líquido), el tetraedro cuaternario es dividido en fases primarias representadas por volúmenes.
La Fig. 7-4 muestra el diagrama correspondiente al sistema albita-anortita-diópsidoforsterita. La importancia de este diagrama, está dada porque las fases cristalinas de este sistema son las que corresponden a gabros y basaltos. El tetraedro está dividido en volúmenes que representan las fases líquidas de los minerales: plagioclasa, diópsido, forsterita y espinela. La presencia de espinela, muestra que este es un sistema pseudo-cuaternario, en el que la composición de la espinela no está dentro del tetraedro, mientras que la mayoría de los líquidos del sistema deberían inicialmente caer dentro del volumen de fase de la plagioclasa, diópsido o forsterita y la cristalización del mineral correspondiente debería migrar desde una de las tres superficies de fase (dos minerales en equilibrio con el líquido) y dos minerales deberían cristalizar juntamente hasta que el líquido alcance la curva de las cuatro fases (tres minerales en equilibrio con el líquido). La curva es mostrada en el diagrama con el descenso desde 1270ºC a 1135ºC. La composición de líquido debe migrar siguiendo esta curva de cristalización de las plagioclasas cálcicas (+ diópsido + forsterita) a la izquierda del líquido enriquecido en los componentes de las plagioclasas sódicas.
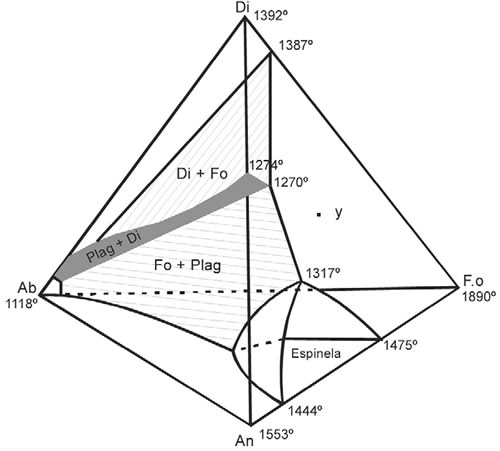
Fig. 7-4. Sistema pseudo-cuaternario Albita-anortita-diópsido-forsterita (Yoder y Tilley 1962).
En un tetraedro las tendencias internas son difíciles de dibujar y en la práctica se hace necesario proyectar los detalles sobre caras particulares, o mostrar cortes del tetraedro. Un corte triangular puede verse como un diagrama ternario ordinario, pero el mismo contendrá componentes cuaternarios, cuya composición no cae sobre el plano de la sección y es así una sección pseudo-ternaria. Una de las cuatro fases de la línea univariante en un sistema cuaternario, corresponde a tres sólidos en equilibrio con un líquido y puede tener la apariencia de un punto invariante ternario, cuando es intersectado por una unión pseudo-ternaria, tal como la intersección llamada “punto de perforación”.
En los análisis de los sistemas experimentales se observan distintas relaciones entre líquidos y cristales ya formados. La importancia de tales relaciones de reacción, fueron claramente reconocidas por Bowen (1922). El consideró que la cristalización de los magmas es controlada por lo que denominó principio de reacción, distinguiendo dos tipos básicos de reacción, que pueden ocurrir bajo condiciones de equilibrio, entre los fundidos y los minerales que se forman a partir de dichos fundidos.
El primer tipo, denominado “serie de reacción continua”, involucra reacciones continuas del tipo:
Mineral(composición A) + Fundido(composición x) = Mineral(composición B) + Fundido(composición y)
o
Fundido(composición x) = Mineral + Fundido(composición y)
Cualquiera de estas reacciones puede involucrar a mas de un mineral cuando C > 2. Ejemplos de este tipo son reacciones de solución sólida, en las que la composición del fundido, o del mineral, o de ambas, varían con la temperatura. En tales reacciones la plagioclasa que coexiste con un fundido se vuelve más sódica; y los olivinos y piroxenas, que coexisten con fundidos, se vuelven más ricos en hierro. Tales reacciones son continuas, en el sentido que la composición de algunas fases, si el equilibrio se mantiene, se ajustan continuamente sobre un amplio intervalo de temperaturas del mineral.
El segundo tipo “serie de reacción discontinua”, tales como:
Fundido = Mineral 1 + Mineral 2
O reacciones peritécticas
Mineral 1 + Fundido = Mineral 2
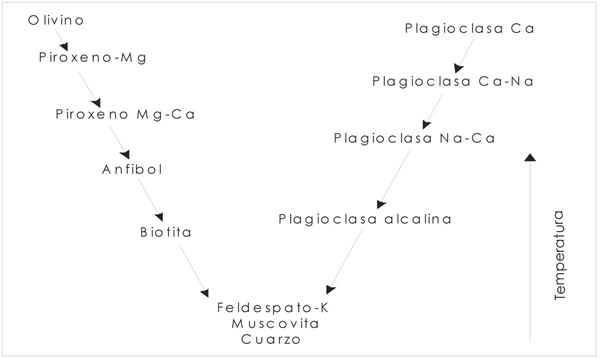
Fig. 7-5. Serie de reacción de Bowen.
Ejemplos de tales reacciones son por ejemplo, Fo + Líquido = En, o el sistema Fo-Di- SiO2, en el que, la piroxena pobre en Ca reacciona con el líquido para formar clinopiroxeno rico en Ca. Tales tipos de reacciones son comunes en la cristalización de magmas y más de una reacción o serie de reacciones, pueden ocurrir simultáneamente o secuencialmente, en fundidos con multicomponentes, como es la “Serie de reacción de Bowen”.
El cambio de entropía y el cambio de volumen asociado con la fusión de casi cualquier sólido, tiene signo positivo y la pendiente de la curva de fusión es positiva, significando que el punto de fusión se incrementa con la presión (P).
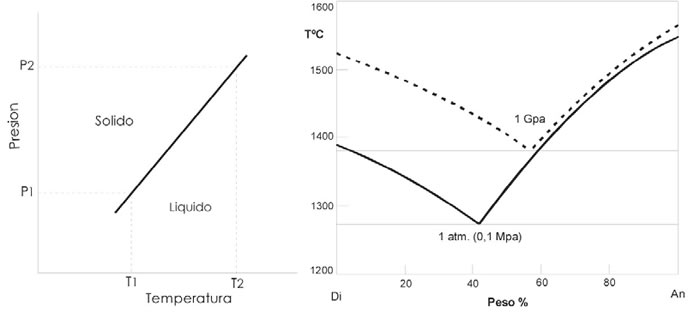
Fig. 7-6. A. Diagrama esquemático ilustrando la elevación de la temperatura de fusión, causada por el incremento de temperatura. B: Efecto de la presión litostática sobre el líquido y la composición eutéctica en el sistema Diópsido- Anortita (Presnall et al. 1978).
La (Fig. 7-6A ) ilustra esquemáticamente el incremento de la temperatura de fusión, desde T1 a T2, que corresponde al aumento de P desde P1 a P2. El incremento dependerá de la pendiente de la curva de equilibrio en un diagrama P-T, que depende de los valores relativos Δs y Δv, de la reacción expresada por la ecuación de Clapeyron.
El incremento de la presión litostática aumenta el punto de fusión de la mayoría de las fases de sólidos (excepto el hielo) y de los líquidos en general. Por ejemplo, el aumento desde 1 atmósfera a 1 Gpa (aprox. 35 km), aumenta el Pf del basalto en aprox. 100º C. La magnitud del efecto de aumento de P no afecta a todos los minerales por igual, por lo que la elevación del Pf, es diferente para cada mineral. Si la superficie del líquido en el diagrama T-X, aumenta diferencialmente, el aumento de P cambia la posición del eutéctico (Fig. 7-6B). El incremento de la P puede también causar inestabilidad en algunas fases minerales y ser reemplazadas por otras. Por ejemplo, los feldespatos se vuelven inestables a alta P y son destruidos con formación de piroxeno Al-Na y/o granates con Al-Ca (como ejemplo las piroxenas de alta presión son más aluminosas que las de baja presión).
El volumen de volátiles en solución que son liberados a una fase libre de vapor, marca la solubilidad de las especies volátiles en los fundidos que son susceptibles a las variaciones de presión. El incremento de la presión puede efectivamente forzar a los volátiles a disolverse en los fundidos silicáticos. A bajas presiones es donde el volumen de gas liberado es mayor.
Los fundidos saturados en fluidos son los que contienen las mayores cantidades de especies volátiles disueltas bajo condiciones de P-T-X. Cualquier volátil presente en exceso a una determinada cantidad se separa, coexistiendo como fase fluida. El término presión de fluidos (Pf) se usa para describir los efectos combinados de presión y contenido de fluidos en un sistema. Un sistema fundido a una presión específica puede variar desde saturado en fluido (Pf = Ptotal) a fluido libre (Pf = 0, llamado “seco”), dependiendo de la cantidad de fluidos disponibles. Pf raramente excede a Ptotal, porque el resultado sería la expulsión del exceso de volátiles por medio de una explosión.
Alternativamente se pueden colectar y analizar gases volcánicos que están escapando, en zonas con volcanismo activo. De estos estudios se aprende que los gases componentes de los magmas son predominantemente del sistema C-O-H-S, siendo H2O y CO2 dominantes, con cantidades menores de CO, O2, H2, S, SO2, y H2S. Se encuentran asimismo cantidades menores de: N, B, Cl y F.
Cuando se coleccionan muestras de roca, el contenido de fluidos, su mayoría se ha perdido y ocasionalmente se observan inclusiones fluidas que son muy pequeñas y que pueden formarse también en estadios post-magmáticos (Fig. 7-7).
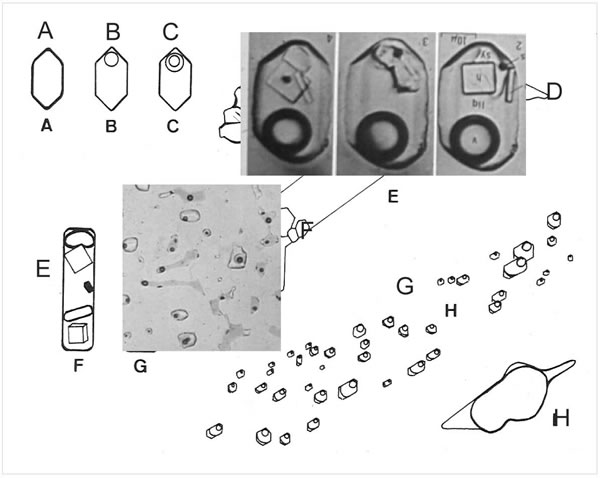
Fig. 7-7. Distintos tipos de Inclusiones fluidas. A: Cristal negativo relleno por una sola fase gaseosa. B: Dos fases, gas y líquido. C: Tres fases, agua y vapor, además de CO2. C: Tres ejemplos de cristales negativos conteniendo además de fases de líquido y vapor, desarrollan cristales de NaCl. E: Inclusión en apatita de carbonatita, con cristales de NaCl y KCl, una fase de sulfato y una fase de gas. F y G: inclusiones fluidas típicas en cristales de cuarzo, con formas redondeadas o de cristales negativos, que contienen una fase líquida y otra gaseosa. H: Inclusión en cuarzo conteniendo metano con una solución salina.
En general los procesos magmáticos tienen lugar en presencia de una o más fases fluidas. La presencia más obvia de la presencia de fluidos en los fundidos silicáticos se observa en las erupciones volcánicas. Mientras que las evidencias de tal presencia en las rocas plutónicas es menos evidente, ya que solo es posible su identificación en las pequeñas inclusiones entrampadas de los volátiles. Debe tenerse cuidado en identificar si tales inclusiones son primarias (formadas durante la cristalización del mineral que las contiene) o secundarias (si se han formado por procesos posteriores como deformación o metamorfismo). Asimismo, las inclusiones primarias, pueden haber sufrido pérdidas durante procesos posteriores a su formación.
La presencia en fundidos silicáticos de gases o soluciones acuosas, ha sido preservada como pequeñas inclusiones entrampadas dentro de cristales de diferentes minerales. Estas inclusiones son pequeñas <1 mm y >100um de diámetro y como generalmente permanecen sin cambios después de su formación, proveen información sobre la presión, temperatura y composición de los fluidos entrampados y que estuvieron presentes durante la cristalización de la roca, que cubre temperaturas entre los 700º y 1200ºC.
Las determinaciones se realizan mediante una platina de calentamiento/enfriamiento que se adosa al microscopio petrográfico y que permite elevar la temperatura hasta que se rellena la cavidad por el fluido, que también conlleva a la disolución de los cristales formados, que indicaría la temperatura de formación y luego bajar la temperatura hasta congelar al fluido, que permite establecer por ejemplo que la inclusión es de H2O pura, o que contiene por ejemplo NaCl, si se forman cristales cúbicos de dicho mineral, durante el proceso de enfriamiento (Fig. 7-7).
Al agregar agua a un sistema anhidro se producen diferentes cambios, ya que la mayoría de los minerales no aceptan mucha H2O y los únicos minerales comunes de las rocas ígneas que la contienen son las micas y los anfíboles, que normalmente están subordinados. En los minerales anhidros, con un componente de fusión de reacción:
Sólido = Líquido
Con el agregado de H2O, se vuelve:
Sólido + H2O = Líquido (acuoso)
Acuoso significa una fase que contiene agua y que debe estar en ambos lados de la última reacción, ya que se encuentra como fase fluida separada a la izquierda y disuelta a la derecha. El porque las fases de alta temperatura en equilibrio, acomodan mejor el H2O que las de baja temperatura, está dada por el Principio de Le Chatelier, que dice que cuando se agrega agua esta causa un nuevo equilibrio en un sistema originalmente anhidro y lo hace más estable con respecto al sólido. El resultado de agregar H2O a un sistema anhidro, es bajar el punto de fusión para una presión dada. En razón que más H2O puede ser forzada a entrar en solución por aumento de P, el punto de fusión se deprime más con el incremento de P.
La Fig. 7-8, ilustra las curvas del solidus para tres rocas ígneas comunes, con composiciones desde ultramáficas a silícicas. En todos los casos, se observa que el agua, disminuye marcadamente el punto de fusión de las rocas. Esto demuestra el importante rol que juega el agua en la generación de fundidos, particularmente en la corteza, donde es más abundante. En presencia de pequeñas cantidades de agua, el punto de fusión de las rocas graníticas en la corteza inferior es de aproximadamente 600ºC, temperatura que es alcanzada durante el metamorfismo.
El principal mecanismo por el cual el H2O se disuelve en los fundidos silicáticos es un proceso por el cual las moléculas de H2O se involucran en una reacción de hidrólisis mediante la cual se conectan con el oxígeno adyacente de los tetraedros SiO4 (polimerización). Por esta reacción de hidrólisis, el H2O se disocia en H+ y OH- e interactúa con la cadena –Si-O-Si-, para formar –Si-OH y HO-Si-. Los iones H+ satisfacen la carga negativa con la posición tetraédrica del oxígeno y la despolimerización reduce la viscosidad de los fundidos altamente polimerizados. La extensión en la que estos procesos tienen lugar depende de la estructura del fundido (que determina el desarrollo de la polimerización).
Un modelo propuesto para las estructuras de los fundidos aluminosilicáticos, sostiene que su estructura es similar a sus equivalentes mineralógicos, teniendo menor orden de los enlaces silicáticos y ausencia de ordenamiento bajo difracción de rayos-X. Un fundido de olivino, no está polimerizado, mientras que un fundido de cuarzo o feldespato, está extensamente polimerizado. Los basaltos son los menos polimerizados y las riolitas las más polimerizadas. Estos establecen una correlación entre la viscosidad y el contenido de sílice y se relaciona con la explosividad de las erupciones volcánicas.
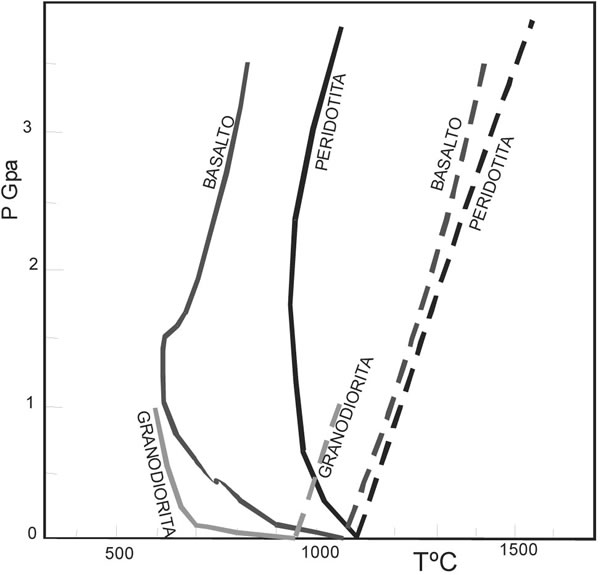
Fig. 7-8. Curvas de comienzo de fusión. Líneas continuas (saturadas en H2O) y líneas de guiones (anhídras), para granodiorita (Robertson y Wyllie 1971); basalto (Lambert y Wyllie 1972) y peridotita seca (Ito y Kennedy 1967), peridotita saturada (Kushiro et al. 1968).
El agua disuelta en los fundidos silicáticos tiene profunda influencia en su comportamiento. Específicamente el H2O disuelta produce:
1.- Despolimerización del fundido. El H2O disuelta en los fundidos silicáticos rompe los polimeros por reemplazo de los puentes de oxígeno, por dos hidroxilos que rompen la estructura del polímero, como sugiere la reacción:
H2O + O2- = 2(OH)-
O sea que el H2O no permanece en solución como moléculas de agua neutrales, sino que se combina con el oxígeno para formar iones hidroxilos, que rompen las cadenas Si – O reduciendo la polimerización.
2. Reduce la viscosidad del fundido, porque despolimeriza el fundido. Los fundidos silícicos ricos en agua pueden ser tan fluidos como los fundidos basálticos. Un pequeño porcentaje en peso de agua disuelta puede ser efectivo reduciendo la viscosidad, pero el agua tiene peso molecular mucho más bajo que los fundidos silicáticos, así que el porcentaje molecular de agua disuelta tiene un valor significativamente grande. En las estructuras abiertas a alta temperatura, tienen gran movimiento los átomos que pueden moverse fácilmente desde posiciones vecinas, permitiendo que la viscosidad disminuya.
3. Incrementa las relaciones de difusión. La difusión gobierna los cambios de estado del sistema, tales como crecimiento de cristales, o reacciones químicas entre diferentes fases.
4. Deprime las temperaturas de cristalización.
5. Se separa y expande en cuerpos someros de magma, produciendo erupciones explosivas. Si un fundido silicático se sobresatura con respecto a algunos constituyentes minerales disueltos, estos se nuclearán y crecerán. Si a alta temperatura el fundido se vuelve sobresaturado en agua y otros volátiles, o sea que la concentración excede la solubilidad, los volátiles se separan del fundido, formando burbujas. Este proceso se denomina vesiculación y ebullición. La ebullición de los magmas crea las fábricas vesiculares, pero en ciertos magmas, la exsolución del gas, produce erupciones explosivas. En general los magmas silícicos e intermedios (riolitas, dacitas, andesitas) y a veces algunos magmas alcalinos máficos, con muy baja SiO2 (tales cono nefelinitas) son muy explosivos; mientras que los magmas basálticos erupcionan con relativa tranquilidad.
Un fundido inicialmente subsaturado en gas puede volverse sobresaturado y hervir, a temperatura constante, o condiciones isotérmicas, si la presión confinante es reducida, lo que ocasiona que la concentración exceda a la solubilidad. La ebullición tiene lugar cuando la presión de vapor del volátil iguala la presión confinante. La ebullición también puede ser causada a presión constante, o condiciones isobáricas, por descenso de temperatura. Esto puede parecer contradictorio, porque a temperatura más baja aumenta la solubilidad, pero con el descenso de temperatura, aumenta la cristalización de minerales anhidros, tales como olivino, feldespatos, piroxenas, etc., y así aumenta la concentración de agua en el fundido residual, lo que contrarresta la mayor solubilidad. Por ejemplo si un magma granítico inicialmente fundido totalmente a P = 0,1 Gpa, T = 900º C y contenido de H2O = 3% peso y se produce la cristalización como sistema isobárico con un descenso de T = 200º C y cristalizan un 50% de feldespatos y cuarzo, el fundido residual tendrá el 6% de H2O, pero se producirá la ebullición antes de llegar a esa concentración, porque el fundido sólo acepta entre el 4 y 5%. Este tipo de ebullición que produce la cristalización se denomina ebullición retrógrada y produce la fábrica vesicular, típica de intrusiones someras y de flujos lávicos en superficie. En los magmas con sólo pocos cristales en suspensión, las vesículas, si no se mueven, tienden a tener forma esférica o elipsoidal, por la tensión superficial del fundido que las rodea. En los magmas ricos en cristales la forma de las cavidades creadas por el gas, están controladas por las caras de los cristales, tomando formas angulares.
6. El agua estabiliza las fases cristalinas hidratadas, tales como micas y anfíboles.
7. La liberación de agua de volcanes y cuerpos intrusivos someros, causa destrucción de los minerales que contienen agua, tales como micas y anfíboles.
8. El agua en sistemas subsolidus promueve la alteración y reemplazo de minerales inestables de alta temperatura, tales como los feldespatos, que pasan a micas y arcillas.
9. Produce la ebullición retrógrada con separación de soluciones acuosas en sistemas plutónicos confinados, produciendo pegmatitas y venas de cuarzo con sulfuros.
La importancia de la ebullición en los magmas va más allá de la creación de estructuras vesiculares. En algunos sistemas, la desmezcla del gas desde el magma provee la fuerza explosiva de las erupciones volcánicas., que depende de varios factores.
Generalmente en los magmas intermedios a silícicos (andesitas, dacitas, riolitas) y también en magmas máficos alcalinos, con bajo contenido en SiO2 (nefelinitas), son mas explosivos que los magmas máficos que erupcionan como lavas relativamente tranquilas. El contenido en SiO2 que controla la viscosidad no es el único factor que gobierna la explosividad. El contenido inicial de volátiles, en depósitos riolíticos piroclásticos, indican bajo contenido de agua, los fenocristales máficos son de piroxeno, más que de hornblenda y biotita y no muestran contenidos apreciables de CO2. Por lo que el contenido inicial de volátiles y la viscosidad están involucrados en el desarrollo de la expansión del gas durante la vesiculación. Este factor es el que determina, si la energía es liberada lentamente o explosivamente.
Considerando dos columnas verticales de magma que ascienden, con contenidos similares de volátiles y que comienzan a hervir a la misma profundidad. En la primera, por su viscosidad más baja o una relación de ascenso más lenta libera el gas en burbujas que se expanden considerablemente al tiempo que la columna se acerca a la superficie, esta expansión acelera la velocidad de ascenso, pero como queda poca presión residual del gas cuando alcanza la salida hay poca tendencia explosiva. En el segundo caso, la columna de magma, tiene poca expansión de gas durante el ascenso, por una más alta viscosidad que retarda la formación de burbujas. En este sistema hay considerable energía y cuando alcanza la salida el magma se desintegra violentamente en una explosión que eyecta al magma en forma fragmentada sobre amplias áreas.
La formación y expansión de las burbujas de gas, es análoga al nucleamiento y crecimiento de cristales. Los experimentos muestran que el crecimiento de las burbujas es rápido, aún en fundidos silícicos altamente viscosos. Aunque la difusión del agua como iones (OH-), en los fundidos es lenta, especialmente en los silícicos, muchas burbujas pequeñas se forman anticipadamente. La expansión del gas en las burbujas está gobernada por la presión confinante sobre el magma y la viscosidad de las paredes de las burbujas. La desmezcla del agua desde el fundido incrementa su viscosidad, reduciendo la velocidad de difusión para que la burbuja crezca, haciendo dificultosa su deformación y expansión. Esto produce una sobrepresión dentro de la burbuja que produce su explosión, desintegrando al fundido en las proximidades de la salida e impulsando los fragmentos hacia el exterior a gran velocidad.
En estadios cerrados de sistemas magmáticos hidratados, la fábrica y la composición mineral de las rocas, pueden ser cambiadas. Diversos estudios de intrusiones magmáticas graníticas, revelan no solo alteración, sino también la formación de cuerpos de pegmatita, de aplitas, de venas de cuarzo y sulfuros, tanto dentro, como en la periferia de los plutones. Las relaciones de fábrica y de campo indican que todos ellos se formaron tardíamente en la evolución de los sistemas magmáticos, aparentemente desde diferentes tipos de soluciones.
El origen y diversidad en la composición de estas soluciones son consecuencia de la ebullición retrógrada y del camino durante el cual los constituyentes químicos son particionados entre fases de cristales, fundidos y volátiles, durante el enfriamiento del magma. La cristalización tiende a enriquecer los fundidos residuales en Na, K y Fe, relativamente al Ca y Mg. La razón está dada por el tamaño iónico, carga y otros factores de enlace, elementos adicionales son la concentración de elementos menores y trazas que no son incorporados y precipitan como cristales, y otros que son altamente concentrados en los líquidos residuales. La lista de los elementos residuales incluye: Li, Be, B, C, P, F, S, Cl, Cu, Zn, Mo, Ag, Sn, W, Au y Pb.
La precipitación de fases anhidras (cuarzo y feldespatos) desde un magma que se enfría, puede incrementar la concentración de agua en el fundido residual, en los estadios tardíos y si el sistema tiene una capa de roca impermeable, la PH2O se vuelve igual a la P confinante y el fundido experimenta ebullición retrógrada. Como la fase rica en vapor de agua bulle estrepitosamente, tendrá una densidad que depende tanto de la presión confinante y su nomenclatura es complicada: vapor, gas, fluido acuoso, solución hidrotermal, son todos estados posibles. Asimismo, una fase rica en agua contiene concentraciones importantes de Na, K y Si disueltos, además de los elementos volátiles: C, P, F, S, Cl, más otros elementos residuales.
Los átomos pueden difundirse mucho más rápidamente en una fase rica en agua, que en un fundido silicático condensado, por lo que la relación de crecimiento cristalino se intensifica, por lo que es importante en el comportamiento y el origen de los cristales gigantes que se encuentran en las pegmatitas y en sistemas plutónicos desarrollados en profundidad.
El sistema fundido residual en el sistema magmático, de los cuerpos pegmatíticos, que cristalizan después de largo tiempo, actúa activamente promoviendo el reemplazo metasomático, que altera a los minerales de alta temperatura en las paredes de las rocas a lo largo de los canales de migración. El fenómeno de ebullición y la expansión volumétrica de sistemas tardíos magmático-hidrotermal en nivel epizonal, puede causar la fracturación de las paredes de roca y debido a la rápida perdida de volátiles, agotan cualquier fundido remanente del magma, producido por intrusivos porfídicos someros. Las soluciones hidrotermales migran por las fracturas de las paredes y las rocas porfíricas pueden precipitar, cantidades económicamente importantes, de sulfuros y óxidos de Mo, Cu, Ag, Au, Zn, Pb y U, junto con grandes cantidades de cuarzo.
Las rocas sedimentarias y volcánicas fracturadas y permeables, que están por encima de muchas intrusiones someras, constituyen lugares ideales para el desarrollo de extensos sistemas hidrotermales. Un sistema hidrotermal típico se asocia con terrenos volcánicos silícicos. Los isótopos estables muestran que el agua meteórica predomina sobre la juvenil o magmática en la mayoría de los sistemas hidrotermales, pero la relación es variable según los sitios. El calor de una cámara magmática somera está típicamente asociada con volcanismo reciente y el agua subterránea calentada, mas el componente de agua juvenil agregada, que se expande y asciende a través del material permeable que está por encima, formando fumarolas y geiseres. El agua que se enfría se desplaza lateralmente y desciende, dando lugar a que más agua caliente ascienda, formando un sistema convectivo por encima del magma solidificado (Fig. 7-9).
Los sistemas hidrotermales, por encima de batolitos someros, puede afectar a volúmenes importantes de roca y el flujo está controlado por la permeabilidad de las rocas sobreyacentes. Importantes sistemas de fracturas se desarrollan encima de las intrusiones, que actúan como conductos efectivos de circulación de los fluidos. Perforaciones en algunos sistemas han llegado a más de 3 km y han encontrado aguas salinas con pH casi neutro y con temperaturas de más de 350ºC. Si la ebullición tiene lugar en la parte superficial del sistema, CO2 y SH2 típicamente se concentran en los vapores, los cuales pueden alcanzar la superficie como fumarolas, o condensarse y oxidarse como sulfatos ácidos o soluciones bicarbonatadas, que son comunes en los campos geotermales.
Los fluidos hidrotermales evolucionan tanto químicamente, como isotópicamente por intercambio con los fundidos silicáticos y/o la parte solidificada del plutón, donde el agua puede ser juvenil o no. Así estos fluidos se enriquecen en los constituyentes que disuelven, los cuales interactúan con las rocas que los rodean, causando cambios químicos, mineralógicos y texturales, que dependen de la temperatura, la permeabilidad, la composición química y la naturaleza de los fluidos y de las rocas. La gran variación de la naturaleza física y química de los sistemas hidrotermales, genera diferentes productos de alteración, que incluyen: cuarzo, feldespatos, clorita, arcillas, calcita, epidota, sulfuros y óxidos, junto a zeolitas, biotita, actinolita, diópsido y granate. Los minerales máficos y vidrio de las volcanitas, son particularmente sensibles a la alteración. La mineralogía de menas y su alteración producen estructuras zoneadas y reflejan gradientes de temperatura y químicos. Tales zonaciones pueden ocurrir a escala pequeña, como en una fractura, o a gran escala como zonas concéntricas por encima del plutón. Importantes yacimientos de interés económico se forman en estos sistemas hidrotermales, siendo fuentes de oro, plata, cobre, plomo, cinc, molibdeno, etc.
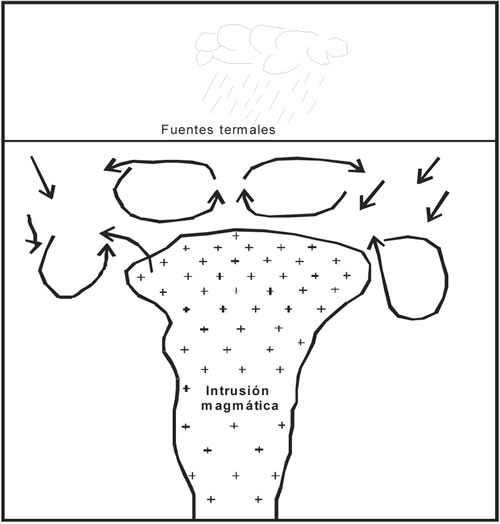
Fig. 7-9. Esquemática de circulación convectiva de agua meteórica, por calentamiento desde una intrusión.
Sistemas análogos han sido reconocidos debajo del fondo oceánico, en las dorsales de distensión se producen centros en los cuales el agua juvenil y el agua oceánica circulan en sistemas convectivos, tales como los humos negros, que son centros de depositación activa de sulfuros metalíferos y que asimismo, soportan una nueva y única comunidad biológica.
Taylor (1978) ha demostrado que en los sistemas plutónicos investigados, particularmente los granitos epizonales, tienen relaciones isotópicas de oxígeno e hidrógeno, enriquecidas en isótopos livianos. Este enriquecimiento produce patrones concéntricos con valores δ16O más altos alrededor del cuerpo magmático. Las rocas graníticas frescas tienen valores δ16O de +7 a +10, mientras que las aguas meteóricas subterráneas están enriquecidas en 16O, en aproximadamente valores -10. Si la intrusión magmática puede controlar la circulación del agua subterránea en un período importante de tiempo, el calentamiento producirá enriquecimiento en O16 en las rocas intrusivas y sedimentarias más ricas en O18 (δ = +10 a +20). La naturaleza de la convección se muestra en la Fig. 7-9.
El descubrimiento de sistemas de convección gigantes, involucran aguas subterráneas que se extienden decenas de kilómetros dentro de la roca de campo, las cuales tienen implicancias para la generación de depósitos minerales hidrotermales, asociados con las intrusiones magmáticas y su enfriamiento. Modelos puramente conductivos se limitan a los casos en que la roca de campo es impermeable.
La solubilidad del CO2 en los fundidos silicáticos, contrasta significativamente con el H2O. El CO2 no disocia ni ataca las ligaduras de los oxígenos, porque el ión C4+ es muy diferente al ión H+. El ión C4+ es más pequeño y de alta carga y no puede establecer cadenas estables con los oxígenos adyacentes al catión Si4+. Consecuentemente el CO2, no se disuelve en forma apreciable en los fundidos, particularmente en los silícicos altamente polimerizados. Las investigaciones han encontrado que la adición de CO2 en los sistemas, muestra poca solución y no cambia, el punto de fusión. Otros investigadores lo han tratado como componente inerte de la fase fluida y tendría un rol de diluyente del H2O, reduciendo la actividad (aH2O) en el fluido. Mientras que el H2O reduce el punto de fusión de la albita, la adición de CO2 parece mitigar dichos efectos y reducen su capacidad para disolverse en el fundido.
El CO2 se disuelve algo en los fundidos silicáticos, especialmente a P>1GPa. Eggler (1973) encuentra que el CO2 se disuelve hasta el 4 – 5 % en fundidos de diópsido, enstatita y albita a altas presiones. Estableciendo que la solubilidad del CO2 depende fuertemente de la composición del fundido, disolviéndose más en los fundidos máficos menos polimerizados (en marcado contraste con el comportamiento del H2O). También encontró que el H2O incrementa marcadamente la solubilidad del CO2 hasta un 35% en diópsido a 2 GPa y al 18% en enstatita, pero sólo en un 5 – 6% en fundidos de albita.
Mysen y Virgo (1980) sugieren que el CO2 se disuelve para formar complejos carbonáticos (CO2- 3), particularmente con el Ca para formar complejos de CaCO3.
La disolución de CO2, produce un descenso del punto de fusión de los silicatos, aunque menos que el H2O. El CO2 tiende a hacer más polimerizado los fundidos, donde el H2O rompe las ligaduras. El CO2 tiende a disolverse más en los fundidos máficos, menos polimerizados y aumenta la viscosidad de los fundidos. Esto también explica porque el CO2 se disuelve más si el H2O está presente, porque el agua crea fundidos menos polimerizados que atraen al CO2. La adición de CO2 desplaza, al eutectico diópsido-anortita a temperaturas más bajas.
Dado que la solución de CO2 tiene lugar a altas presiones y en composiciones máficas, los efectos deben ser mayores en el manto. El CO2 debería influir en el descenso del punto de fusión en rocas del manto sólido, causando fusión incipiente de basaltos alcalinos y por supuesto el volumen de fusión dependerá tanto de la temperatura como de la cantidad de CO2 disponible. También tiene influencia el CO2 en la fusión de peridotitas y en la formación de carbonatitas.
Todos los magmas naturales contienen disueltos agua, anhídrido carbónico y otros componentes volátiles que pueden ser absorbidos o expulsados de los complejos ha medida que el magma se separa de la fuente y que va cristalizando en profundidades someras. La dificultad radica en conocer que proporciones de estos gases estuvieron presentes en la fuente. Estudios de volcanes continentales indican que el CO2 puede ser el gas dominante en profundidad y que la mayor parte del agua expulsada durante las erupciones, es tomada de la corteza. La mayoría de los componentes volátiles conocidos derivados del manto, provienen de las lavas vítreas dragadas del fondo oceánico, donde las presiones son tan altas que pocos escapes tienen lugar antes que la lava se enfríe. CO2, H2O y cantidades menores de gases sulfurosos, constituyen los volátiles más importantes, además de cloro y flúor que están en muy pequeñas cantidades.
La solubilidad de los gases en los magmas varía con la presión, la temperatura y la composición, tanto del gas como del líquido (Fig. 7-10). La simple experiencia de destapar una botella de cerveza o de champagne, permite observar la formación de numerosas burbujas que escapan del líquido, lo que ilustra claramente, que la solubilidad de un gas decrece con la presión confinante, o bien cuando la temperatura aumenta. Este efecto produce disminución de volumen en el magma, porque un líquido con gases disueltos ocupa mayor volumen, que uno sin gases. Por estas razones, el contenido de gas en una columna de magma, es mayor en la parte superior que en profundidad.
La mayoría de los magmas ricos en sílice, puede retener más agua que los magmas máficos y el efecto se incrementa por tener temperaturas de formación más bajas. Si otro gas está presente, como el CO2, este reduce la solubilidad del agua. Aunque los constituyentes volátiles solo son una pequeña fracción en peso de los magmas y su peso molecular es bajo, su correspondiente fracción molecular es mucho mayor y tienen gran influencia sobre las propiedades físicas, como la viscosidad y determina el orden de cristalización de los minerales. Muchos volátiles se pierden de las rocas volcánicas, antes de que comience su cristalización, mientras que en las rocas plutónicas, estos son retenidos e incorporados en algunos minerales estables. El agua por ejemplo, entra en los minerales hidratados, anfíboles y micas, y los sulfuros se combinan con hierro o cobre para formar sulfuros. Pocas rocas ígneas contienen carbonatos u otros minerales con CO2, pero en algunos casos forman las carbonatitas. Los halógenos son constituyentes esenciales de apatita, turmalina, topacio y algunos anfíboles.
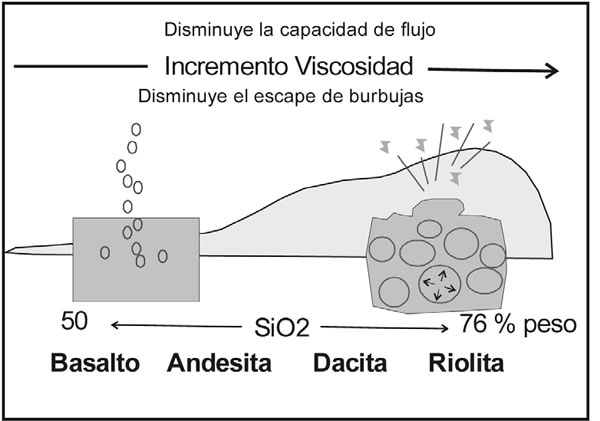
Fig. 7-10: Clasificación de los magmas volcánicos, según el contenido de SiO2 y de volátiles, que controlan su viscosidad, condicionan su capacidad de fluir y su potencial explosividad. (Modificado de Millery Wark 2008).
Bowen, N.L. 1915. Crystallization-differentiation in silicate liquids. Amer. J. Sci. 39: 175-191.
Bowen, N.L. 1922. The reaction principle in petrogenesis. J. Geol. 30: 177-198.
Eggler, D.H. 1973. Role of CO2 in melting processes in the mantle. Carnegie Inst. Washington Yearb. 73: 215-224.
Irvine, T.N. 1975. Olivine-pyroxene-plagioclase relations in the system Mg2SiO4-CaAl2Si2O8-KAlSi3O8-SiO2 and their bearing on the differentiation of stratiform intrusions. Carnegie Inst. Washington Yearb. 74: 492-500.
Ito, K., y Kennedy, G.C. 1967. Melting and phase relations in a natural peridotite to 40 kilobars. Amer. Jour. Sci. 265: 519-538.
Kushiro, I., Yoder jr., H.S., y Nishikawa, M. 1968. Effect of water on the melting of enstatite. Geol. Soc. Am. Bull. 79: 1685-1692.
Lambert, I.B., y Wyllie, P.J. 1972. Melting of gabbro (quartz eclogite) with excess water to 35 kilobars, with geological applications. J.Geol. 80: 693-708.
Morse, S.A. 1994. Basalts and Phase Diagrams. An introduction to the Quantitative Use of Phase Diagrams in Igneous Petrology. Krieger, Malaber, FL.
Mysen, B.O., y Virgo, D. 1980. Solubility mechanisms of carbón dioxide in silicate melts. A Raman spectroscopic study. Amer. Mineral. 65: 885-899.
Presnall, D.C., Dixon, S.A., Dixon, J.R., O´Donnell, T.H., Brenner, N.L., Schrock, R.L., Dycus, D.W. 1978. Liquidus phase relations on the join dioside-forsterite-anorthite from 1 atm to 20 kbar: Their bearing on the generation and crystallization of basaltic magma. Contrib. Mineral. Petrol. 66: 203-220.
Robertson, J.K., y Willey, P.J. 1971. Experimental studies on rocks from the Deboullie Stock, northern Maine, including melting relations in the water deficient environment. J.Geol. 79: 549-571.
Schairer, J.F., y Yoder jr, H.S. 1960. The nature of residual liquids from crystallization, with data on the system nepheline-diopside-silica. Am. J. Sci. 258A: 273-283.
Yoder, H.S., y Tilley, C.E. 1962. Origin of basalt magmas: An experimental study of natural and synthetic rock systems. J. Petrol. 3: 342-532.