Aves del Valle del Río Paraná en la Provincia del Chaco, Argentina: Riqueza, Historia Natural y Conservación
Mario L. CHATELLENAZ 1
1 Departamento de Biología, Facultad de Ciencias Exactas y Naturales y Agrimensura, Universidad Nacional del Nordeste. Av. Libertad 5470, (3400) Corrientes, Argentina. E-mail: mchatellenaz@yahoo.com.ar
Abstract: BIRDS OF THE PARANÁ RIVER FLOODPLAIN IN CHACO PROVINCE, ARGENTINA: SPECIES RICHNESS, NATURAL HISTORY AND CONSERVATION. In this study, species richness, natural history and conservation of birds community of the Paraná River Floodplain in Chaco, Argentina, were described. In the studied area, 261 species were registered, which 168 were resident and 54 migrant. Palm grovestall grasslands and riparian forest were the habitats of the higher species richness, with 124 and 113 species of birds respectively. Data of the reproduction to 216 species were given too. Sixteen species of this area were considered threatened. Suggestions of future studies are proposed to promote conservations and sustainable use of these valuable environments.
Key words: Birds - Paraná River Floodplain - Chaco - Argentina.
Palabras clave: Aves - Valle de inundación del Paraná - Chaco - Argentina.Introducción
La región Chaqueña, una de las más extensas de América del Sur, se extiende por 1.200.000 km2, de los cuales unos 800.000 pertenecen a la Argentina. Predominan los bosques xerófilos, las sabanas húmedas y semiáridas, en muchos casos con palmares. En esta gran planicie las precipitaciones disminuyen de este a oeste desde 1200 a 450 mm anuales, y el régimen de lluvias es estacional, con mayores precipitaciones en verano (Canevari et al. 1998). Los humedales de esta región son más abundantes en el este, en cercanías de la confluencia de los ríos Paraná y Paraguay. Aguas debajo de su confluencia con el río Paraguay, el río Paraná se ensancha enormemente, originando una vasta planicie fluvial con amplias terrazas, que pueden superar los 30 km de extensión (Popolizio 1989, Orfeo 1996). Esta compleja planicie aluvial comprende lagunas de espiras, lagunas deltaicas, esteros y antiguos cauces abandonados, regionalmente denominados “madrejones”, flanqueados por elevaciones formadas por depósitos de sedimentos fluviales (“albardones”). Este sistema se caracteriza por estar sometido a un régimen de inundación anual y plurianual, cuya extensión y duración varían con el nivel alcanzado por ambos ríos durante su fase de aguas altas, las que van de mayo a octubre en el caso del río Paraguay y de diciembre a abril en el caso del Paraná. A esto se suma el aporte de los ríos Pilcomayo y Bermejo que también contribuyen a las inundaciones del Chaco Oriental.
A pesar de su gran escala y límites imprecisos, constituyen una unidad bien definida, con claras vinculaciones biogeográficas con el Pantanal de Mato Grosso en Brasil (Bonetto y Hurtado 1998). El Chaco, junto a la Selva Paranaense y las Yungas son los tres biomas de mayor biodiversidad de la Argentina (Bucher y Chani 1998). Sus humedales constituyen un área importante de refugio y alimentación de larvas y juveniles de muchas especies de peces durante los periodos de inundaciones, albergan a las dos especies de yacarés presentes en nuestro territorio (Caiman yacare y C. latirostris) y al pez pulmonado sudamericano Lepidosiren paradoxa, por mencionar sólo unos pocos ejemplos. Debido a su importancia, el valle de inundación de los ríos Paraná y Paraguay en la provincia de Chaco, fue declarado sitio Ramsar en febrero de 2004, bajo el nombre de “Humedales Chaco”, abarcando 508.000 ha (Ramsar 2004). Este sitio se continúa hacia el sur, con otro sitio Ramsar, “Jaaukanigás”, en el valle del Paraná Medio santafecino.
A pesar de ser un área prioritaria para la conservación, y aunque existen varias publicaciones sobre características limnológicas, geomorfológicas y florísticas del área situada pocos kilómetros debajo de la confluencia de los ríos Paraná y Paraguay (Eskuche 1986, 1999, 2004; Fontana 1991; Orfeo 1996; Poi de Neiff y Neiff 1980; Poi de Neiff y Carignan 1997, entre otros), muchos aspectos de estos humedales permanecen poco conocidos, entre ellos, la composición e historia natural de su avifauna.
La avifauna de la provincia del Chaco cuenta 427 especies, el 42,7% de las 998 especies citadas para
Argentina (Mazar Barnett y Pearman 2001). No obstante, la mayor parte de los registros han sido
obtenidos en tierras ajenas al valle del río Paraná, en comunidades vegetales mesófilas y semixerófilas.
Entre las publicaciones referidas específicamente al área de estudios, se encuentra la de Short (1975),
quien aunque trató la avifauna de toda la región chaqueña, mencionó como hábitat de varias especies
los bosques ribereños de los ríos Paraná y Paraguay; el atlas ornitogeográfico de la provincia del
Chaco de Contreras et al. (1990), que aunque se refiere únicamente a No Passeriformes, mapea para
el área numerosas especies. Chébez et al. (1999) citaron a Pulsatrix perspicillata (Strigidae) como nueva
especie para la provincia en base a un registro en la selva riparia; Chatellenaz y Ferraro (2000) al
estudiar materiales vegetales y fúngicos presentes en nidos, analizaron varios de ellos provenientes
del valle de inundación; Chatellenaz (2002a ) estudió la dieta de dos especies de Basileuterus de la selva
riparia, y posteriormente citó a Nemosia pileata para la provincia del Chaco, en base a varios registros en
el área (2002b).
Por lo expuesto, esta contribución tiene como objetivo brindar información acerca de la composición de la avifauna del valle del río Paraná en la provincia del Chaco, obtenida a través de trabajos de campo y búsqueda bibliográfica, aportando datos de fenología, reproducción, hábitats frecuentados y estado de conservación, además de sugerencias para futuras investigaciones.
Área de estudios
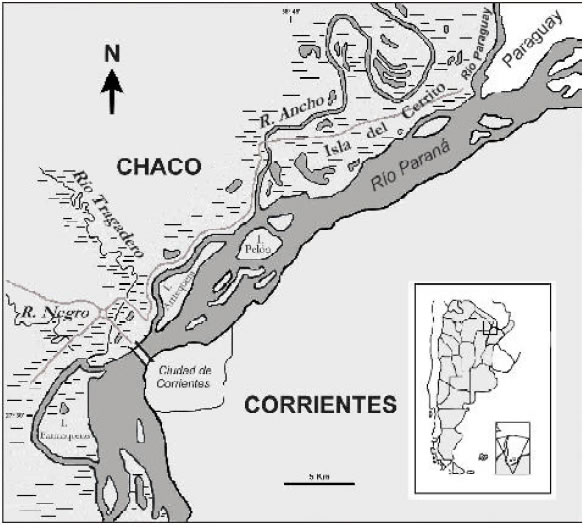
El área donde se llevaron a cabo las prospecciones y en la que se centró la revisión bibliográfica, se encuentra comprendida entre la confluencia de los ríos Paraná y Paraguay hasta la desembocadura del río Tragadero, cerca de la localidad de Barranqueras (27º 29’ S, 58º 56’ W), provincia del Chaco, Argentina (Fig. 1). En la mayor parte de los casos, los datos fueron tomados en una faja de 3 km de ancho a partir del río Paraná, la que se inunda en crecientes ordinarias. Esta faja constituye la “planicie de inundación proximal” (Orfeo 1996), y es donde se desarrollan las comunidades vegetales acuáticas y semiterrestres características del valle.
El clima del área es subtropical: siete meses con temperatura media superior a los 20º C, los restantes entre 10 y 20º C (Koeppen 1948, cit Eskuche 1984). Esta área está inserta en la zona de mayores precipitaciones del Chaco, con promedios anuales de entre 1200 y 1300 mm, con alta concentración en verano-otoño (Bucher y Chani 1998).
En lagunas y madrejones se encuentran mantos de hidrófitos natantes flotantes, como los helechos Salvinia biloba, S. auriculata y Azolla caroliniana, junto a otras especies como Lemna minuscula, Wolffiella lingulata, Pistia stratiotes y camalotales de Eichhornia crassipes. También están presentes, durante la temporada estival, llamativos hidroterófitos radicantes natantifolios como el irupé (Victoria cruziana), de grandes hojas circulares y flores de intenso perfume. Radicando en el fondo o en la orilla de los cuerpos de agua poco profundos, se encuentran cañaverales de Cyperus giganteus, Schoenoplectus californicus, y en menor medida, Typha dominguensis (Fontana 1991, Eskuche 2004).

Fig. 1. Ubicación del área de estudios.
Sobre los albardones crecen comunidades vegetales semiterrestres, como la selva riparia (Fig. 2 A) y pajonales. La sucesión primaria de la vegetación comienza con el bosquecillo pionero de Salix humboldtiana y Tessaria integrifolia, sobre sedimentos aluviales recientes depositados por las inundaciones, y culmina con la selva riparia de Bergeronia sericea y Cathormion polyanthum como comunidad final. El bosquecillo de Salix y Tessaria es posteriormente reemplazado por la comunidad de prebosque de Croton urucurana y Cecropia pachystachya, que antecede a la selva riparia. También actúa como comunidad de cicatrización de la misma, donde el fuego o la tala la hayan destruido, estableciéndose en los claros (Eskuche 2004).
La selva riparia crece en estrechas franjas, sobre los albardones más altos, donde sólo la alcanzan las inundaciones de importancia (Fig. 2 B). Junto a las dos especies mencionadas, figuran en el estrato arbóreo alto de la selva (20-25 m) Ruprechtia brachysepala, Geoffroea striata, Ocotea suaveolens, Banara arguta y Nectandra microcarpa; en el estrato arbóreo bajo (12-15 m), Guarea spicaeflora, Pithecellobium cauliflorum y Pouteria gardneriana. En el estrato arbustivo se encuentran en abundancia Eugenia moraviana y Psychotria carthagenensis, mientras que el estrato herbáceo es pobre en especies, debido al efecto de barrido de las crecientes, con Panicum stoloniferum como especie característica. Existen numerosas trepadoras y lianas, como así también epífitos vasculares (cactáceas, bromeliáceas, piperáceas, orquídeas y helechos); además, briófitos y líquenes.
Es conveniente aclarar que la selva riparia aquí descripta no es equivalente, fitosociológicamente, a las “selvas ribereñas”, “selvas marginales”, etc., de Martínez-Crovetto (1963), Cabrera (1976) y Carnevali (1994). Estos autores, en sus listas florísticas incluyeron no sólo a las especies de selva higrófila, sino también a numerosas especies de bosque y selva de tierras altas que, aunque forman parte de la “galería” que acompaña a los ríos, crecen por encima del nivel de inundaciones (Eskuche y Fontana 1996). Por lo tanto, pertenecen a otras comunidades de bosque, no consideradas en este trabajo.
En sectores donde quemas repetidas impiden el retorno de la selva, crecen palmares de Copernicia alba y pajonales de Panicum prionitis, de hasta 2,5 m de altura. Además, en las partes más elevadas y que reciben inundaciones con menor frecuencia, se encuentran otras comunidades de pastizales y pajonales, de menor porte.

Fig. 2A. Vista aérea del valle de inundación en cercanías del Puente interprovincial “General Belgrano”. Nótese las lagunas de espiras y las franjas de selva riparia.

Fig. 2.B. Albardón con selva riparia, flanqueado por lagunas con camalotales de Eichhornia spp.
Métodos
El área fue visitada desde 1996 hasta 2003, en todas las estaciones del año. Los datos fueron obtenidos mediante conteos por puntos (Reynolds et al. 1980; Bibby et al. 1993 ) y observaciones asistemáticas en todas las comunidades vegetales mencionadas. El río Tragadero y algunas de las lagunas fueron recorridos en piragua, para registrar aves acuáticas.
Se efectuó una revisión de la bibliografía disponible sobre la avifauna del valle del río Paraná Medio superior, sintetizada en buena parte por Contreras et al. (1990) y De La Peña (1999). Los datos aportados por estos autores primero se interpretaron, para establecer si las especies citadas correspondían al área de estudio, descartándose los registros dudosos. Luego se verificó la información disponible acerca del hábitat de estas especies, para inferir la probabilidad de su presencia en alguno de los hábitats del área.
Por razones operativas, se definieron ocho tipos de hábitats, algunos de los cuales engloban a varios más reducidos. Los mismos fueron: selva riparia, prebosque, bosquecillo pionero, palmarpajonal, lagunas, cañaverales y aire. Las tres comunidades de bosque se mantuvieron como entidades separadas debido a que difieren florística y estructuralmente, y por lo tanto, en las posibilidades de refugio, alimentación y nidificación que pueden brindar a las aves. El palmar-pajonal incluyó no sólo a estas dos formaciones, sino también a matorrales. Por su parte, las lagunas comprendieron a las lagunas de espiras, madrejones, esteros y charcas, incluyendo la vegetación acuática y las orillas barrosas, que en algunos casos están desprovistas de vegetación. Los cañaverales, aunque crecen también en las orillas de lagunas, se consideraron aparte, ya que difieren significativamente de las restantes comunidades vegetales acuáticas flotantes y arraigadas. El hábitat “ríos” comprendió al Tragadero y al Paraná, tanto sus aguas abiertas como sus márgenes, que, al igual que en el caso de las lagunas, son importantes para especies limícolas como cuervillos, chorlos y playeros.
Por último, se consideraron dos hábitats particulares: aire y peridomicilio. El primero incluyó a aquellas especies cazadoras de insectos en vuelo, que pasan la mayor parte del tiempo volando o planeando, sin mostrar afinidades significativas por alguno de los otros hábitats (Blake et al. 1990, Karr 1990). El peridomicilio se definió debido a la presencia de especies vinculadas exclusivamente a asentamientos humanos.
Se diferenciaron dos grupos de aves en cada hábitat: especies “exclusivas” y especies “adicionales”, en el sentido de Robinson y Terborgh (1990): las primeras consistieron en aquellas que fueron halladas sólo en un hábitat durante los muestreos, o se sabe que están restringidas al mismo. Las segundas fueron las que ocurrieron regularmente en varios hábitats, sin restringirse a uno en particular.
Los datos sobre fenología y reproducción se basaron en la información publicada para el nordeste de Argentina (Short 1975; Olrog 1979; Contreras 1990, Contreras et al. 1990; Chatellenaz 2000, 2002; Fraga 2001; Mazar Barnett y Pearman 2001; Giraudo et al. 2003). Se consideraron las siguientes categorías de migrantes, según Giraudo et al.(op. cit.):
• Residentes: aves que se reproducen en el área y residen en ella a lo largo de todo el año.
• Migrantes Australes hacia el Norte: aves que se reproducen en el área y migran hacia las zonas
tropicales del norte durante el invierno austral.
• Migrantes Australes hacia el Sur: se las encuentra en el área durante otoño-invierno, migrando al
sur para reproducirse en primavera-verano.
• Migrantes Neárticos: especies que se reproducen en el hemisferio Norte y migran al hemisferio
Sur en la primavera austral, correspondiente al otoño boreal.
• Migrantes Regionales: aves que realizan desplazamientos dentro de la región. La mayoría de ellas
son aves acuáticas. En algunas especies, parte de la población permanece en el área, y otra parte de la misma efectúa movimientos migratorios, pero sus patrones son pobremente conocidos (Hayes
1996).
• Ocasionales: especies que cuentan con escasos registros, sea porque son aves de paso o accidentales
en el área, o bien se presentan en muy baja cantidad, no pudiendo ser asignadas a las categorías
anteriores.
Los datos de nidificación se obtuvieron a través de registros de nidos activos en el campo, observaciones de despliegues nupciales, cópulas y construcción de nidos, presencia de juveniles, además de la bibliografía antes citada.
El estatus de conservación, a nivel nacional e internacional, de las especies halladas se obtuvo de Fraga (1996) y BirdLife International (2000, 2005), respectivamente.
En la nomenclatura de las especies se siguió a Mazar Barnett y Pearman (2001). No obstante, en lo relativo a dos familias se utilizó un arreglo más tradicional. Así, en el caso de los géneros Pachyramphus y Tityra, del grupo Schiffornis, considerado “insertae sedis”, se optó por razones prácticas, mantenerlos dentro de Tyrannidae. Del mismo modo, se mantuvo a Phytotoma rutila dentro de la familia Phytotomidae, en vez de Cotingidae.
Resultados
Composición general de la avifauna. Se registró para el área un total de 261 especies de aves, pertenecientes a 20 órdenes y 54 familias (Ver Apéndice 1). Estas 261 especies representan el 61 % de las 427 especies citadas para la provincia del Chaco (Saibene 1985; Bertonatti y Heinonen Fortabat 1988; León y Díaz Neto 1988; Contreras 1986; Contreras et al. 1990; De La Peña 1999; Chébez et al. 1999; Chatellenaz 2002). Fueron registradas 65 especies de aves acuáticas, pertenecientes a 16 familias, tanto en las playas de los ríos Paraná y Tragadero, en las márgenes de lagunas y madrejones, como en aguas abiertas. Las restantes 196 ocurren en hábitats terrestres y semiterrestres, los cuales incluyen todas las comunidades de bosque, palmares y pajonales.
La familia más numerosa fue Tyrannidae, con 29 especies (11 % del total), seguida por Accipitridae con 21 (8 %), Anatidae y Emberizidae con 13 cada una (5 %, respectivamente), Rallidae, Picidae e Icteridae con 12 en cada caso (4,6 %) y Ardeidae con 11 especies (4,2 %). Las restantes familias oscilaron entre una y ocho especies.
El que la familia Accipitridae sea la segunda en número después de Tyrannidae, se debe sin duda a la heterogeneidad ambiental del valle de inundación. Esto permite múltiples oportunidades de alimentación a especies muy disímiles en sus hábitos: desde aquellas como el Gavilán Caracolero, que se alimentan de grandes caracoles del género Pomacea; de peces y otros animales acuáticos en el caso del Aguilucho Pampa (Busarellus nigricollis), de insectos, como los milanos del género Ictinia, a aquellas que capturan aves y mamíferos, como el Esparvero Común, Accipiter erythronemius, y grandes águilas como Buteogallus urubitinga.
No obstante, en relación al número de especies presentes en Argentina, Ardeidae e Icteridae son las mejor representadas en el área. Para la primera están citadas 14 especies en nuestro país: teniendo en cuenta que 11 de ellas están en el valle del Paraná chaqueño, aquí se encuentra el 78,5 % de las especies de garzas de la Argentina. Por su parte, las 12 especies de la familia Icteridae del área de estudios, representan el 63 % de las 19 que integran la avifauna de nuestro país.
Riqueza por hábitat. Considerando las tres comunidades de bosque, se observó un incremento de la riqueza específica de acuerdo al estadio de sucesión (Tabla 1). Así, el bosquecillo pionero registró el menor número de especies, seguramente debido a su simplicidad estructural, y no tuvo especies exclusivas. La riqueza se incrementó notablemente a partir de la comunidad de prebosque, probablemente debido a que la misma en muchos casos, se halla combinada con los estadios jóvenes de la selva riparia, configurando una hábitat estructuralmente más complejo (Eskuche 2004). Aunque tampoco cuenta con especies exclusivas, a diferencia del bosquecillo pionero el prebosque tiene un mayor porcentaje de especies migrantes (20 %). La selva riparia guarda ciertas similitudes con las “matas ciliares” del Brasil Central, no solo en su disposición a lo largo de cuerpos de agua y su escaso ancho (Fig. 2 y 3), sino también en que la mayoría de las aves presentes son oportunistas, con una distribución geográfica y un espectro ecológico amplios (Silva y Vielliard 2000). Esto se vio reflejado en el reducido número de especies exclusivas y el elevado número de especies adicionales de esta formación vegetal.
Si se las considera en conjunto, las tres comunidades de bosque reúnen 190 especies de aves.
El palmar-pajonal, fue el hábitat con mayor riqueza específica, incluso con mayor porcentaje de especies exclusivas, aunque menor porcentaje de migrantes que la selva riparia (Tabla 1). Esto puede deberse a un sesgo impuesto al simplificar quizá demasiado, y reunir en una misma categoría a palmares, pajonales pastizales y matorrales. Dada la complejidad del mosaico, no siempre fue fácil decidir dónde terminaba una formación vegetal y dónde comenzaba otra, por lo que el agrupamiento respondió más bien a una razón operativa. De todos modos, es el hábitat que eligen muchas especies caminadoras, como tinámidos (Rhynchotus rufescens, Nothura maculosa) y algunos rálidos (Aramides ypecaha), más otras vinculadas a los palmares como ciertos carpinteros (Colaptes campestris, Melanerpes cactorum), o passeriformes de áreas abiertas (Satrapa icterophrys, Tyrannus savana, Ammodramus humeralis, Sporophila spp.), por citar unos pocos ejemplos.
A pesar de su menor riqueza, las lagunas, esteros, madrejones y charcas reunieron un alto número de especies exclusivas, y también el mayor número de migrantes (27). Los camalotales y otras comunidades de hidrófitos flotantes que tapizan a la mayoría de estos cuerpos de agua, ofrecen un sustrato de refugio y alimentación a especies que se desplazan sobre ellos, como Jacana jacana y rálidos de los géneros Porphyrio, Pardirallus y Gallinula. Passeriformes como Serpophaga subcristata y Embernagra platensis, entre otros, suelen circunstancialmente posarse sobre la vegetación acuática en busca de alimento. Incluso un psitácido, Nandayus nenday, fue vista posada en bandadas sobre una población de Victoria cruziana en fructificación, alimentándose de sus semillas (Eskuche 2004). De hecho, la mayoría de las especies frecuenta una variedad de hábitats.
Llamó la atención el escaso número de individuos de la familia Anatidae observados a lo largo de las visitas al área, que en cambio fueron frecuentemente hallados en mayores concentraciones a poca distancia del valle de inundación. Lo mismo es válido en el caso de podicipédidos, y especies del género Fulica, a pesar de la abundancia de esteros, bañados y lagunas. Al respecto, Fraga (2001) atribuyó la escasez de patos en los cuerpos de agua de la Estancia “San Juan Poriahú” (Corrientes) a la pobreza de las aguas en nutrientes y organismos planctónicos, y a la predación ejercida por los yacarés. En todas las lagunas del área de estudio, los yacarés fueron una presencia notoria y común. No obstante, el papel que podrían jugar en el escaso número de patos y gallaretas debería ser evaluado.
Los ríos reunieron el menor número de especies exclusivas (Anhinga anhinga, Chlidonias niger y Rynchops niger), compartiendo las restantes con las lagunas. Como en éstas, las márgenes arenosas o barrosas son un sitio importante para varias especies como cuervillos (Threskiornithidae), chorlitos, playeros (Charadriidae, Scolopacidae) y otras, quienes buscan su alimento (pequeños invertebrados) hurgando con sus picos entre el barro o la arena. Los cañaverales, aunque con baja riqueza y una sola especie de migrante detectada en ellos (Fluvicola albiventer), son un hábitat que contiene a especies cuya biología es poco conocida. Por ejemplo, se encuentran ardeidos como Botaurus pinnatus, rálidos como Laterallus melanophaius, L. leucopyrrhus, Pardirallus maculatus, y passeriformes propios de ellos (Donacobius atricapillus, Amblyramphus holosericeus). No obstante, es un hábitat que podría contener a muchas otras especies no detectadas hasta el momento, sobre todo rálidos de pequeño tamaño. Estas especies se caracterizan por su modo de vida sigiloso, ocultas entre la vegetación palustre.
Por último, dos especies fueron registradas exclusivamente en el peridomicilio: la Paloma Doméstica Columba livia y el Gorrión Passer domesticus, ambas exóticas. Cinco especies (cuatro golondrinas y un vencejo), fueron registradas como aéreas.
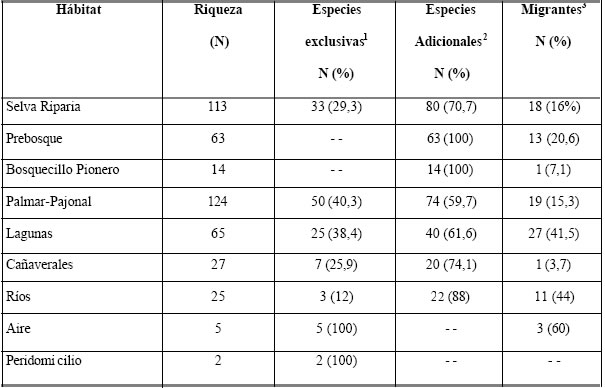
Tabla 1. Riqueza específica y migrantes presentes en cada hábitat del valle de inundación del río Paraná en el
Chaco.
1 Especies halladas solamente en este hábitat durante muestreos, o señalada por la bibliografía para el mismo.
2 Especies halladas en varios hábitats además del consignado.
3 Incluye a migrantes australes hacia el sur y hacia el norte, migrantes neárticos y regionales, incluso aquellos
con cierto grado de duda.
Fenología. Con respecto a la fenología de las especies registradas, 168 (64,3 %), son residentes
con seguridad en el área, mientras que 14 son consideradas como tales con dudas (5,3 %). Cincuenta
y cuatro (21 %) son migrantes, y siete (3%) probablemente también lo sean. Tres especies (1,1%) son
consideradas ocasionales en el área, más una probable, en tanto no está claro el estatus de 14 especies
(5,3%) (Ver Apéndice 1).
• Migrantes Australes hacia el Norte: comprenden 20 especies, el 37 % de los migrantes, más una
asignada con dudas a esta categoría. La familia con mayor número de especies en esta categoría fue
Tyrannidae, con 11 especies (12, si se incluye a Tityra cayana). Cuculidae e Hirundinidae contaron dos
especies cada una, mientras que las restantes familias (Accipitridae, Caprimulgidae, Apodidae,
Vireonidae y Emberizidae), una sola especie.
• Migrantes Australes hacia el Sur: ocho especies, el 15 % de las especies migrantes, más tres
especies dudosas. Anatidae reunió cuatro especies, seguida por Tyrannidae con dos, y Caprimulgidae
y Phytotomidae con una especie cada una. Tres especies, pertenecientes a las familias Podicipedidae
(Rollandia rolland), Accipitridae (Circus cinereus) y Tyrannidae (Suiriri suiriri), probablemente integren
esta categoría.
• Migrantes Neárticos: siete especies, que representan el 13 %. La familia más numerosa fue Scolopacidae, con cuatro especies, seguida por Accipitridae con dos, y Laridae con una especie.
• Migrantes Regionales: diecinueve especies, el 35% del total, más dos probables (Buteo albicaudatus y Anas versicolor). La familia Anatidae reunió seis especies, seguida por Ardeidae con cuatro, y Ciconiidae
y Threskiornithidae con tres cada una. Phalacrocoracidae, Anhingidae y Accipitridae solo tuvieron
una especie por familia (Phalacrocorax brasilianus, Anhinga anhinga y Rostrhamus sociabilis, respectivamente).
Aparentemente, estos desplazamientos guardan relación con las fluctuaciones del nivel
hídrico y la disponibilidad de alimento (Contreras et al. 1990).
• Ocasionales: se consideraron como tales a tres especies (1,1 %) pertenecientes a las familias
Accipitridae y Falconidae (2 y 1, respectivamente), y otra perteneciente a Psittacidae (Nandayus nenday),
fue señalada como tal con dudas.
Catorce especies (5,3%) no pudieron ser asignadas a ninguna de estas categorías por informaciones contradictorias en la bibliografía consultada o carencia de datos al respecto.
Nidificación. De acuerdo a las observaciones de campo y la bibliografía consultada, 216 especies (82,7 % del total) se reproducen en el área con certeza; otras 14 probablemente lo hacen. Diecinueve especies, el 7,2 %, (migrantes neárticas u ocasionales) no se reproducen en el área, y de doce (4,5 %) no se tienen datos (Ver Apéndice 1).
Conservación
La acelerada tasa de degradación de los humedales del centro de Sudamérica, es debida principalmente a la deforestación y erosión de las cuencas hidrológicas, y la construcción de represas en los grandes ríos. A esto se suma el inminente desarrollo de la Hidrovía Paraná-Paraguay, para navegación, irrigación y control de las inundaciones, que provocará un significativo impacto sobre los ríos y grandes humedales de la región (Canevari et al. 1998). Por lo tanto, es prioritario contar con información sobre la avifauna de los valles de estos ríos y sus afluentes, a fin de poder monitorear las respuestas de sus poblaciones a los cambios ambientales (Hayes 1996).
Dieciséis especies detectadas o citadas para el área se encuentran incluidas en alguna de las categorías de riesgo a nivel nacional (Fraga 1996), discriminadas de la siguiente manera: una especie en peligro, cinco vulnerables, cuatro de riesgo bajo y seis consideradas con datos insuficientes. A nivel internacional (BirdLife International 2000, 2005), una especie está considerada en peligro, otra califica como vulnerable, y otras dos cercanas a la amenaza (Tabla 2).
La presencia de estas especies añade por sí sola, un valor especial a la conservación al área.
Aunque parezca obvio, no se debe olvidar que es imposible proteger a la avifauna sin proteger a las comunidades vegetales en las que viven. Las 12 asociaciones vegetales del valle de inundación del río Paraná en el área de estudio reúnen 270 especies de plantas, muchas de ellas exclusivas. La destrucción de la selva riparia significaría la pérdida de 92 especies; y la de las lagunas y madrejones, la desaparición de 45 especies de plantas de la flora argentina (Eskuche 2004). Por el momento es imposible precisar el número de especies animales, tanto vertebrados como invertebrados que podrían desaparecer junto a ellas.
Urge adoptar medidas efectivas de protección de un área de tanta importancia biológica y paisajística, ya que a pesar de su status de sitio Ramsar, la caza y la tala, incluso de los renovales de especies arbóreas, son constantes. Además, los pobladores de la zona hacen entrar el ganado vacuno y equino a la selva y sitios con vegetación acuática para que se alimente. En época de sequía suelen quemar los pajonales y demás formaciones herbáceas, ingresando frecuentemente el fuego al interior de la selva, con los daños consiguientes. Este modo de utilización de los recursos del área, sobre todo de la selva riparia, permite prever su completa degradación en el lapso de unos pocos años, si continúa al ritmo actual. Esta no es una preocupación menor, si consideramos que la selva riparia del Alto Paraná correntino fue destruida casi en su totalidad por acción humana, en forma de tala, fuego y pastoreo (Eskuche y Fontana 1996).
No obstante, la conservación de las comunidades vegetales y animales del valle de inundación del Paraná chaqueño no será posible sin una adecuada divulgación y concientización de la sociedad chaqueña. La comunidad científica deberá trabajar en conjunto con organizaciones no gubernamentales y la comunidad del área, para definir criterios comunes y lograr un equilibrio entre el uso de los recursos de este gran humedal y la conservación de los mismos. Una alternativa válida, aún no explotada, es el turismo ecológico, ya que más allá de la pesca del Dorado (Salminus maxillosus) en Isla del Cerrito, no se han hecho intentos de atraer turistas a otros sitios del área. La belleza paisajística de selva, riachos, lagunas y madrejones, además de las posibilidades de realizar observaciones y fotografía de fauna emblemática (carpinchos, yacarés y un sinnúmero de aves acuáticas y terrestres), sería un atractivo de primer orden y una posibilidad de aprovechamiento no extractivo para los habitantes del área.
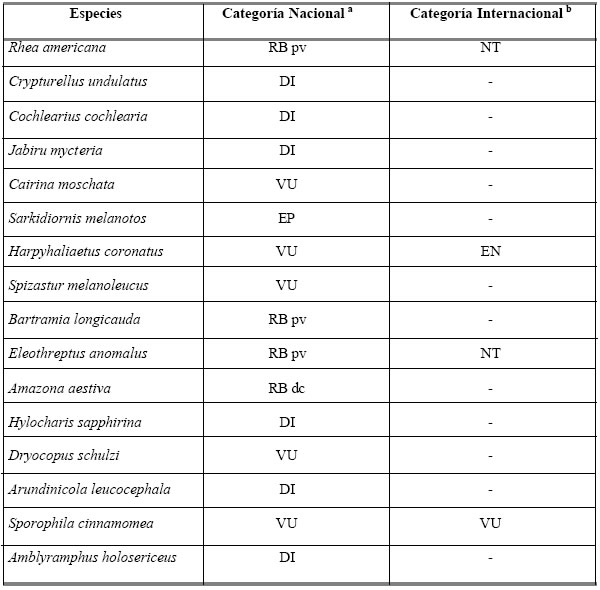
Tabla 2. Especies de aves amenazadas presentes en el valle del Paraná chaqueño.
1 Categorías a nivel nacional: EP: en peligro; VU: vulnerable; RBpv: riesgo bajo, potencialmente vulnerable;
RBdc: riesgo bajo, dependiente de la conservación; DI: datos insuficientes.
2 Categorías a nivel internacional: EN: en peligro; VU: vulnerable; NT: cercana a la amenaza.
Perspectivas para futuras investigaciones
Probablemente el inventario realizado es aún incompleto, y será necesario realizar muestreos adicionales para tener una idea exacta acerca de la composición de la avifauna del área, como así también para precisar la biología de muchas especies acerca de las que poco se sabe. Un ejemplo significativo de lo expuesto es el gran número de especies cuyo estatus de residencia y su reproducción en el área son inciertos o completamente desconocidos. Asimismo, deberá confirmarse la presencia actual de varias de las especies citadas por otros autores en las décadas de 1980 y 1990, las cuales no han sido registradas durante las recientes visitas al área. Desde luego, esto podría deberse a deficiencias en los muestreos, además de bajas densidades poblacionales, los hábitos esquivos o crípticos de estas especies, o su rareza.
Aspectos ecológicos tales como el papel de muchas especies de aves como agentes de polinización y dispersión de árboles, arbustos y lianas de la comunidad de prebosque y la selva riparia permanecen desconocidos. Eskuche (2004) basándose en los caracteres morfológicos de flores y frutos, determinó que muchas de ellas son polinizadas y dispersadas por aves, y destacó la necesidad de identificar y estudiar a las especies nectarívoras y frugívoras.
Un aspecto que debería tenerse en cuenta en investigaciones futuras, es la realización de trabajos en comunidades vegetales debidamente definidas por estudios fitosociológicos adecuados. Vuilleumier (1993) señaló que la mayoría de los hábitats determinados por ornitólogos corresponden a unidades de vegetación mal definidas. Sostuvo la necesidad de que los censos de aves fueran llevados a cabo en unidades vegetales definidas en primer lugar por botánicos y ecólogos vegetales, no por ornitólogos, a menos que posean los conocimientos adecuados. De otro modo no es posible determinar las relaciones muchas veces sutiles entre las aves y los distintos tipos de vegetación. Debe establecerse una estrecha cooperación multidisciplinar entre fitosociólogos y ornitólogos para poder establecer correlaciones entre la composición y estructura de la avifauna y las comunidades vegetales donde viven (Silva y Vielliard 2000), sobre todo en áreas con un complejo de vegetación tan heterogéneo como lo es el valle del río Paraná en toda su extensión. Teniendo en cuenta esto, sería deseable la realización de investigaciones que establezcan con mayor exactitud el hábitat específico de muchas de las aves aquí citadas.
Estos estudios deberán complementarse con análisis a largo término de la dinámica temporal y espacial de la avifauna, lo que permitirá contar con la información básica imprescindible para la adopción de futuras medidas de manejo y conservación.
Agradecimientos
A Mariano Ordano, compañero de muchas salidas de campo en el área, por compartir desinteresadamente sus conocimientos. José L. Fontana cedió gentilmente las fotografías aéreas que acompañan el trabajo, y leyó críticamente el manuscrito. Los dres. Oscar Orfeo, Ulrich Eskuche y Alicia Poi de Neiff, suministraron bibliografía y aportaron valiosos comentarios. Celeste Franceschini, Juan M. Coronel y Osvaldo Arbino colaboraron en distintos aspectos del trabajo.
Apéndice 1
Lista de aves del valle del río Paraná en la provincia del Chaco. Se incluyen datos de hábitats frecuentados,
fenología y reproducción en el área.
a Hábitats: SR=selva riparia; Pb=pre-bosque; Bp= bosquecillo pionero; PP=palmar-pajonal; L=lagunas;
C=cañaverales; R=ríos; A=aire; Per=peridomicilio.
b Estatus de residencia: R=residente; MAS=migrante austral hacia el sur; MAN=migrante austral hacia el norte;
MN=migrante neártico; MR=migrante regional; O=ocasional; MAS?=estatus de residencia dudoso; ?=se
desconoce.
c Nidificación: N=nidifica en el área; N?=probablemente nidificante; ?=se desconoce.
| FAMILIAS Y ESPECIES |
Ha | ERb | Nc |
| Familia Rheidae | |||
| Rhea americana | PP | R | N? |
| Familia Tinamidae | |||
| Crypturellus undulates | SR | R | N |
| Crypturellus tataupa | SR | R | N |
| Rhynchotus rufescens | PP | R | N |
| Nothura maculosa | PP | R | N |
| Familia Podicipedidae | |||
| Rollandia rolland | L,R | MAS? | ? |
| Tachybaptus dominicus | L,R | ? | ? |
| Podicephorus major | L,R | ? | - |
| Familia Phalacrocoracidae | |||
| Phalacrocorax brasilianus | L,R | R-MR | N |
| Familia Anhingidae | |||
| Anhinga anhinga | R | R-MR | N |
| Familia Ardeidae | |||
| Tigrisoma lineatum | L,C | R | N |
| Cochlearius cochlearia | L,R | ? | ? |
| Ixobrychus involucris | C,R | R | N |
| Botaurus pinnatus | C | R? | N? |
| Nycticorax nycticorax | L,R | R | N |
| Syrigma sibilatrix | PP,L | R | N |
| Ardea cocoi | L,R | R-MR | N |
| Ardea alba | L,R | R-MR | N |
| Egretta thula | L,R | R-MR | N |
| Bubulcus ibis | PP | R-MR | N |
| Butorides striatus | C,L,R | R? | N |
| Familia Threskiornithidae | |||
| Phimosus infuscatus | L,R | R-MR | N |
| Plegadis chihi | L,R | R-MR | N |
| Theristicus caerulescens | L,R | ? | N? |
| Theristicus caudatus | L,R | ? | - |
| Ajaia ajaja | L,R | R-MR | ? |
| Familia Ciconiidae | |||
| Mycteria americana | PP,L | R-MR | N |
| Ciconia maguari | PP,L | R-MR | N |
| Jabiru mycteria | PP,L | R-MR | N |
| Familia Cathartidae | |||
| Coragyps atratus | SR.PP | R | N |
| Cathartes aura | PP | R | N |
| Cathartes burrovianus | PP | R | N |
| Familia Anhimidae | |||
| Chauna torquata | PP.L | R | N |
| Familia Anatidae | |||
| Dendrocygna viduata | L | R-MR | N |
| Dendrocygna autumnalis | L | R-MR | N |
| Dendrocygna bicolor | L | R-MR | N |
| Coscoroba coscoroba | L | MAS | - |
| Cygnus melanocorypha | L | MAS | - |
| Cairina moschata | L | R-MR | N |
| Callonetta leucophrys | L | R | N |
| Sarkidiornis melanotos | L | R-MR | N |
| Amazonetta brasiliensis | L | R | N |
| Anas platalea | L | MAS | - |
| Anas cyanoptera | L | MAS | - |
| Anas versicolor | L | MR? | - |
| Familia Accipitridae | |||
| Pandion haliaetus | R, L | MN | - |
| Leptodon cayanensis | SR | R? | N? |
| Gampsonyx swainsonii | SR,Pb,PP | R? | N? |
| Elanus leucurus | PP | R | N |
| Rostrhamus sociabilis | L | R-MR | N |
| Ictinia mississippiensis | SR,PP | MN | - |
| Ictinia plumbea | SR,PP | MAN | N |
| Circus buffoni | PP,C,L | R | N |
| Circus cinereus | PP | MAS? | - |
| Accipiter erythronemius | SR | R | N |
| Geranospiza caerulescens | SR,PP | R | N |
| Buteogallus urubitinga | SR,PP | R | N |
| Buteogallus meridionalis | PP | R | N |
| Parabuteo unicinctus | PP | ? | ? |
| Busarellus nigricollis | SR,Bp,PP,L | R | N |
| Geranoaetus melanoleucus | PP | R? | N? |
| Harpyhaliaetus coronatus | SR,PP | R? | N? |
| Buteo magnirostris | SR,Bp,PP | R | N |
| Buteo albicaudatus | PP | R-MR? | ? |
| Buteo polyosoma | PP | O | - |
| Spizastur melanoleucus | SR,R | O | - |
| Familia Falconidae | |||
| Herpetotheres cachinnans | SR,Pb,PP | R? | N? |
| Caracara plancus | SR,PP | R | N |
| Milvago chimango | PP | R | N |
| Milvago chimachima | SR,Pb,PP | R | N |
| Falco sparverius | PP | R | N |
| Falco femoralis | Bp,Pb,PP | R | N |
| Falco peregrinus | SR | O | - |
| Familia Cracidae | |||
| Ortalis canicollis | SR | R | N |
| Familia Rallidae | |||
| Laterallus melanophaius | C,PP | R | N |
| Laterallus leucopyrrhus | C,PP | R | N |
| Aramides cajanea | PP,C | R | N |
| Aramides ypecaha | SR,Pb,PP,C | R | N |
| Porzana albicollis | PP,C | R | N |
| Pardirallus maculatus | PP,C | R | N |
| Pardirallus sanguinolentus | C,PP | R | N |
| Porphyrio martinicus | L | R | N |
| Gallinula chloropus | L | R | N |
| Fulica leucoptera | L | ? | ? |
| Fulica armillata | L | ? | ? |
| Fulica rufifrons | L | ? | ? |
| Familia Aramidae | |||
| Aramus guarauna | PP,C,L,R | R | N |
| Familia Jacanidae | |||
| Jacana jacana | L | R | N |
| Familia Rostratulidae | |||
| Nycticryphes semicollaris | L | ? | ? |
| Familia Recurvirostridae | |||
| Himantopus melanurus | L | R | N |
| Familia Charadriidae | |||
| Vanellus chilensis | PP,L | R | N |
| Charadrius collaris | L,R | R | N |
| Familia Scolopacidae | |||
| Gallinago paraguaiae | PP,L | R | N |
| Bartramia longicauda | PP | MN | - |
| Tringa flavipes | L | MN | - |
| Tringa solitaria | L | MN | - |
| Actitis macularia | L | MN | - |
| Familia Laridae | |||
| Chlidonias niger | R | MN | N |
| Phaetusa simplex | L,R | R | N |
| Sterna superciliaris | L,R | R | N |
| Rynchops niger | R | R | N |
| Familia Columbidae | |||
| Columba livia | Per | R | N |
| Columba picazuro | SR,PP | R | N |
| Columba maculosa | SR,Pb,PP | R | N |
| Columba cayennensis | SR | R | N |
| Zenaida auriculata | PP | R | N |
| Columbina picui | PP | R | N |
| Columbina talpacoti | PP | R | N |
| Leptotila verreauxi | SR,Bp,Pb | R | N |
| Familia Psittacidae | |||
| Aratinga acuticaudata | SR,Pb,PP | R | N |
| Aratinga leucophthalmus | SR,Pb,PP | R | N |
| Nandayus nenday | SR,PP | O? | ? |
| Pyrrhura frontalis | SR,Pb,PP | R | N |
| Myiopsitta monachus | SR,Pb,PP | R | N |
| Forpus xanthopterygius | SR,Pb,PP | R | N |
| Pionus maximiliani | SR | R | N |
| Amazona aestiva | SR | R | N |
| Familia Cuculidae | |||
| Coccyzus cinereus | SR,PP | ? | N |
| Coccyzus melacoryphus | SR,PP | MAN | N |
| Piaya cayana | SR,Pb | R | N |
| Crotophaga major | SR,Pb | MAN | N |
| Crotophaga ani | Bp,Pb,PP | R | N |
| Guira guira | PP | R | N |
| Tapera naevia | Pb,PP | R | N |
| Familia Tytonidae | |||
| Tyto alba | SR,PP | R | N |
| Familia Strigidae | |||
| Otus choliba | SR,PP | R | N |
| Bubo virginianus | SR,PP | R | N |
| Pulsatrix perspicillata | SR | R | N? |
| Glaucidium brasilianum | SR | R | N |
| Athene cunicularia | PP | R | N |
| Asio flammeus | PP | R | N |
| Familia Nyctibiidae | |||
| Nyctibius griseus | SR,PP | R? | N |
| Familia Caprimulgidae | |||
| Podager nacunda | PP | R | N |
| Caprimulgus rufus | SR,Pb | MAN | N |
| Caprimulgus longirostris | PP | ? | ? |
| Caprimulgus parvulus | PP | MAS | N |
| Hydropsalis torquata | SR,PP | R? | N |
| Eleothreptus anomalus | PP | R? | N |
| Familia Apodidae | |||
| Chaetura meridionalis | A | MAN | N |
| Familia Trochilidae | |||
| Anthracothorax nigricollis | SR,Pb,PP | ? | ? |
| Chlorostilbon aureoventris | SR,Pb,PP | R | N |
| Hylocharis sapphirina | SR | R | N |
| Hylocharis chrysura | SR,Pb,PP | R | N |
| Heliomaster furcifer | PP | R? | N |
| Familia Trogonidae | |||
| Trogon surrucura | SR,Pb | R? | N |
| Familia Alcedinidae | |||
| Megaceryle torquata | L,R | R | N |
| Chloroceryle amazona | L,R | R | N |
| Chloroceryle americana | L,R | R | N |
| Familia Ramphastidae | |||
| Ramphastos toco | SR | R | N |
| Familia Picidae | |||
| Picumnus cirratus | SR | R | N |
| Melanerpes candidus | SR,PP | R | N |
| Melanerpes cactorum | PP | R | N |
| Picoides mixtus | PP | R | N |
| Veniliornis passerinus | SR | R | N |
| Piculus chrysochloros | SR | R | N |
| Colaptes melanochloros | SR,PP | R | N |
| Colaptes campestris | PP | R | N |
| Celeus lugubris | SR | R | N |
| Dryocopus lineatus | SR | R | N |
| Dryocopus schulzi | SR | R | N |
| Campephilus leucopogon | SR | R | N |
| Familia Furnariidae | |||
| Furnarius rufus | PP | R | N |
| Schoeniophylax phryganophila | PP,C | R | N |
| Synallaxis frontalis | SR,Pb,PP | R | N |
| Certhiaxis cinnamomea | C,L | R | N |
| Phacellodomus ruber | SR,Pb,PP | R | N |
| Phleocryptes melanops | C | R | N |
| Coryphistera alaudina | PP | R | N |
| Familia Dendrocolaptidae | |||
| Sittasomus griseicapillus | SR | R | N |
| Xiphocolaptes major | SR,PP | R | N |
| Dendrocolaptes platyrostris | SR | R | N |
| Lepidocolaptes angustirostris | SR,Pb,PP | R | N |
| Campylorhamphus trochilirostris | SR | R | N |
| Familia Thamnophilidae | |||
| Taraba major | RF,Bp,Pb | R | N |
| Thamnophilus caerulescens | SR | R | N |
| Familia Tyrannidae | |||
| Hemitriccus margaritaceiventer | SR,Pb | R | N |
| Camptostoma obsoletum | SR,Bp,Pb,PP | R | N |
| Suiriri suiriri | SR,Pb | MAS? | N |
| Elaenia flavogaster | SR,Pb,PP | MAN | N |
| Elaenia spectabilis | SR,Pb,PP | MAN | N |
| Serpophaga subcristata | SR,Bp,Pb,PP | MAS | N |
| Pseudocolopteryx flaviventris | C | R? | N |
| Tolmomyias sulphurescens | SR | R | N |
| Cnemotriccus fuscatus | SR | R | N |
| Lathrotriccus euleri | SR,Pb | MAN | N |
| Pyrocephalus rubinus | Pb,PP | MAN | N |
| Xolmis irupero | PP | R | N |
| Hymenops perspicillata | PP,L | R | N |
| Fluvicola albiventer | PP,C,L | MAS | N |
| Arundinicola leucocephala | PP,C,L | R | N |
| Satrapa icterophrys | PP | R | N |
| Machetornis rixosus | PP | R | N |
| Myiarchus swainsoni | SR,Pb | MAN | N |
| Myiarchus ferox | SR,Pb | R | N |
| Myiarchus tyrannulus | SR,Pb | R | N |
| Tyrannus melancholicus | SR,Pb,PP | MAN | N |
| Tyrannus savana | PP | MAN | N |
| Megarynchus pitangua | SR,Pb | MAN | N |
| Myiodynastes maculatus | SR,Pb,PP | MAN | N |
| Pitangus sulphuratus | SR,Bp,Pb,PP,C,L | R | N |
| Pachyramphus viridis | SR | R | N |
| Pachyramphus polychopterus | SR | MAN | N |
| Pachyramphus validus | SR | MAN | N |
| Tityra cayana | SR | MAN? | N |
| Familia Phytotomidae | |||
| Phytotoma rutila | SR,Pb | MAS | N |
| Familia Vireonidae | |||
| Cyclarhis gujanensis | SR,Pb | R | N |
| Vireo olivaceus | SR,Pb | MAN | N |
| Familia Corvidae | |||
| Cyanocorax cyanomelas | SR | R | N |
| Cyanocorax chrysops | SR,Pb | R | N |
| Familia Hirundinidae | |||
| Progne chalybea | A | MAN | N |
| Progne tapera | A | MAN | N |
| Tachycineta leucorrhoa | A | R | N |
| Stelgidopteryx fucata | A | R | N |
| Familia Troglodytidae | |||
| Donacobius atricapillus | C | R | N |
| Troglodytes aedon | SR,Bp,Pb,PP | R | N |
| Familia Polioptilidae | |||
| Polioptila dumicola | SR,Bp,Pb,PP | R | N |
| Familia Turdidae | |||
| Turdus rufiventris | SR,Pb | R | N |
| Turdus amaurochalinus | SR,Pb | R | N |
| Familia Mimidae | |||
| Mimus saturninus | PP | R | N |
| Familia Parulidae | |||
| Parula pitiayumi | SR,Bp,Pb | R | N |
| Geothlypis aequinoctialis | PP,C | R | N |
| Basileuterus culicivorus | SR,Pb | R | N |
| Basileuterus leucoblepharus | SR,Pb | R | N |
| Familia Thraupidae | |||
| Conirostrum speciosum | SR | R | N |
| Thlypopsis sordida | SR,Pb | R | N |
| Nemosia pileata | SR,Pb | R | N |
| Tachyphonus rufus | SR,Pb | R | N |
| Thraupis sayaca | SR,Bp,Pb | R | N |
| Euphonia chlorotica | SR,Pb | R | N |
| Familia Emberizidae | |||
| Coryphospingus cucullatus | SR,Pb,PP | R | N |
| Poospiza melanoleuca | SR,Pb,PP | R | N |
| Sporophila collaris | PP,C | R | N |
| Sporophila caerulescens | PP | R | N |
| Sporophila leucoptera | PP,C | ? | ? |
| Sporophila cinnamomea | PP | MAN | N |
| Sicalis flaveola | PP | R | N |
| Embernagra platensis | PP | R | N |
| Paroaria capitata | PP,L,R | R | N |
| Paroaria coronata | PP | R | N |
| Arremon flavirostris | SR,Pb | R | N |
| Ammodramus humeralis | PP | R | N |
| Zonotrichia capensis | PP | R | N |
| Familia Cardinalidae | |||
| Saltator coerulescens | SR,Pb,PP | R | N |
| Saltator similis | SR,Pb | R | N |
| Saltator aurantiirostris | PP | R | N |
| Familia Icteridae | |||
| Cacicus solitarius | SR,Pb | R | N |
| Cacicus chrysopterus | SR,Pb | R | N |
| Icterus cayanensis | SR,Pb,PP | R | N |
| Agelaius cyanopus | C,L | R | N |
| Agelaius thilius | C | R? | N? |
| Agelaius ruficapillus | C | R? | N? |
| Agelaioides badius | Bp,Pb,PP | R | N |
| Gnorimopsar chopi | PP | R | N |
| Amblyramphus holosericeus | C | R | N |
| Molothrus bonariensis | PP | R | N |
| Molothrus rufoaxillaris | PP | R | N |
| Sturnella superciliaris | PP | R | N |
| Familia Fringillidae | |||
| Carduelis magellanica | PP | R | N |
| Familia Passeridae | |||
| Passer domesticus | Per | R | N |
Bibliografía
Bertonatti, C. y S. Heinonen Fortabat. 1988. Dos especies nuevas para la provincia del Chaco, República Argentina. Nótulas Faunísticas 14: 1-3.
Bibby, C.J.; N.D. Burgess & D.A. Hill. 1993. Bird census techniques. Academic Press. 257 p. London.
BirdLife International. 2000. Threatened Birds of the World. Lynx Edic. and BirdLife International. Barcelona and Cambridge.
BirdLife International. 2005. Globally threatened species in Argentina. (http://www.birdlife.net/datazone/species/index.html). Fecha de consulta: 22 de febrero de 2005.
Blake, J. G.; F.G. Stiles & B.A. Loiselle. 1990. Birds of La Selva Biological Station: Habitat use, trophic composition, and migrants. Pp. 161-181. In: A. H. Gentry (Ed.): Four Neotropical Rainforests. Yale University Press. New Haven.
Bonetto, A. y S. Hurtado. 1998. Región I. Cuenca del Plata. Pp. 37-72. En: P. Canevari, D. Blanco, E. H. Bucher, G. Castro y I. Davidson (Eds.): Los humedales de laArgentina. Clasificación, situación actual, conservación y legislación. Wetlands International, Publ. Nº 46. Buenos Aires.
Bucher, E. H. y J. M: Chani. 1998. Región II. Chaco. Pp. 75-96. En: P. Canevari, D. Blanco, E. H. Bucher, G. Castro y I. Davidson (Eds.): Los humedales de la Argentina. Clasificación, situación actual, conservación y legislación. Wetlands International, Publ. Nº 46. Buenos Aires.
Cabrera, A. L. 1976. Regiones fitogeográficas argentinas. Enciclop. Arg. Agric. y Jardinería II. 1. 2 ª ed.., Buenos Aires, 85 p.
Canevari, P.; D. E. Blanco; E. H. Bucher; G. Castro y I. Davidson. 1998. Sección I. Los humedales de la Argentina. Pp. 1-24. En: P. Canevari, D. E. Blanco; E. H. Bucher; G. Castro y I. Davidson. Los humedales de Argentina. Clasificación, situación actual, conservación y legislación. Wetlands International, Publ. Nº 46. Buenos Aires.
Carnevali, R. 1994. Fitogeografía de la provincia de Corrientes. Ed. del autor. Corrientes, 324 p.
Contreras, J. R. 1990. Datos reproductivos de 45 especies de aves Passeriformes que anidan en el valle aluvial del Riachuelo, noroeste de Corrientes, Argentina. Nótulas Faunísticas 22: 1-4.
Contreras, J. C. y A. O. Contreras. 1986. Un ave nueva para el “Impenetrable” chaqueño: el Anambé Castaño. Nuestras Aves 11: 9-10.
Contreras, J. L.; L. M. Berry; A. O. Contreras; C. C. Bertonati y E. C. Utges. 1990. Atlas ornitogeográfico de la provincia del Chaco, República Argentina. I. No Passeriformes. Ed. L.O.L.A. Buenos Aires, 165 p.
Chatellenaz, M. L. y L. I. Ferraro. 2000. Materiales vegetales y fúngicos en nidos de aves del noreste argentino y Paraguay. Facena 16: 103 -119.
Chatellenaz, M. L. 2002a. Análisis de la dieta de dos especies del género Basileuterus (Aves: Parulidae) del nordeste argentino. Comunicaciones Científicas y Tecnológicas, Universidad Nacional del Nordeste, Resistencia. (http://www.unne.edu.ar/cyt/2002/cyt/htm).
Chatellenaz, M. L. 2002b. Nemosia pileata (Wied, 1831) (Aves, Emberizidae), nueva especie para la avifauna chaqueña. Facena 18: 57-58.
Chebez, J. C.; O. Braslavsky; T. Derwidee y A. Soria. 1999. Novedades ornitogeográficas argentinas V. Nuestras Aves 40: 5-6.
De La Peña, M. R. 1999. Aves argentinas: lista y distribución. Monografía L.O.L.A. 18. Buenos Aires, 244 p.
Eskuche, U. 1984. Vegetationsgebiete von Nord-und Mittelargentinien. Phytocoenologia 12 (2-3): 185-199.
Eskuche, U. 1986. Relación sobre la 17ª Excursión Fitogeográfica Internacional por la Argentina Septentrional. En: U. Eskuche y E. Landolt (Eds.), Contribuciones al conocimiento de flora y vegetación del norte de la Argentina. Veröff. Geobot. Inst. ETH, Stiftung. Rübel in Zürich 91:12-177.
Eskuche, U. 1999. El régimen de inundaciones y su influencia sobre la vegetación de la vega del Río Paraná Medio Superior, ayer y hoy. Fol. Bot. et Geobot. Correntesiana 14: 1-16.
Eskuche, U. 2004. La vegetación de la vega del río Paraná Medio superior, Argentina. Fol. Bot. et Geobot. Correntesiana 17: 1-60.
Eskuche, U. y J. L. Fontana. 1996. La vegetación de las islas argentinas del Alto Paraná. I. Las comunidades de bosque. Fol. Bot. et Geobot. Correntesiana 11: 1-13.
Fontana, J. L. 1991. Las comunidades vegetales de una laguna chaqueña del valle del Río Paraná. Fol. Bot. et Geobot. Correntesiana 6: 1-17.
Fraga, R. M. 1996. Sección III. Aves. Pp. 155-219. En: García Fernández, J. J.; R. A. Ojeda; R. M. Fraga; G. B. Díaz y R. J. Baigún (Comp.): Libro Rojo de Mamíferos y Aves Amenazados de la Argentina. FUCEMA., Buenos Aires, 221 p.
Fraga, R. M. 2001. The avifauna of Estancia San Juan Poriahú, Iberá Marshes, Argentina: checklist and some natural history notes. Cotinga 16: 81-86.
Giraudo, A. R., M. L. Chatellenaz, C. A. Saibene, M. A. Ordano, E. R. Krauczuk, J. Alonso y A. Di Giacomo. 2003. Avifauna del Iberá: composición y datos sobre su historia natural. Pp. 195-234. En: B.B. Álvarez (Ed.): Fauna del Iberá. EUDENE. Corrientes.
Hayes, F. E. 1996. Seasonal and geographical variation in resident waterbird populations along the Paraguay River. Hornero 14: 14-26.
Karr, J. R. 1990. The avifauna of Barro Colorado Island and the Pipeline Road, Panamá. Pp. 183-198. In: A. H. Gentry (Ed.): Four Neotropical Rainforests. Yale University Press. New Haven.
León, O. D. y S. Díaz Neto. 1988. Observación del Gaviotín Negro Chlidonias niger surinamensis (Gmelin, 1789) (Aves, Sternidae) en el Departamento San Fernando, Chaco, Argentina. Nótulas Faunísticas 12: 1-2.
Martínez-Crovetto, R. 1963. Esquema fitogeográfico de Misiones (República Argentina). Bonplandia 1: 171-223.
Mazar Barnett J. M. y M. Pearman. 2001. Lista comentada de las aves argentinas. Lynx Edic. Barcelona, 164 p.
Olrog, C.C. 1979. Nueva lista de la avifauna argentina. Opera Lilloana 27: 1-327.
Orfeo, O. 1996. Geomorfología del sistema fluvial Paraguay-Paraná en el área de su confluencia. XIII Congreso Geológico Argentino y III Congreso de Exploración de Hidrocarburos (Buenos Aires), Actas IV: 131-147.
Poi de Neiff, A. y J. J. Neiff. 1980. Los camalotales de Eichhornia crassipes en aguas lóticas del Paraná y su fauna asociada. Ecosur 7: 185-199.
Poi de Neiff, A. y R. Carignan. 1997. Macroinvertebrates on Eichhornia crassipes roots in two lakes of the Paraná River floodplain. Hydrobiologia 345: 185-196.
Popolizio, E. 1989. Algunos elementos geomorfológicos condicionantes de la organización espacial y las actividades del NEA. Geociencias 17: 3-12.
Ramsar. 2004. Humedales Chaco. (http//: ramsar.org/wwd2004_rpt_argentina3.htm). Fecha de consulta: diciembre de 2004.
Reynolds, R. T.; J. M. Scott & R. A. Nussbaum. 1980. A variable circular plot-method for estimating bird numbers. Condor 82: 309-313.
Robinson, S. K. & J. Terborgh. 1990. Bird communities of the Cocha Cashu Biological Station in Amazonian Peru. Pp. 199-216. In: A. H. Gentry (Ed.): Four Neotropical Rainforests. Yale University Press. New Haven.
Saibene, C. 1985. Registros nuevos para el Chaco. Nuestras Aves 7: 6.
Short, L. L. 1975. A zoogeographic analysis of the South American Chaco avifauna. Bull. Am. Mus. Nat. Hist. 154 (3): 163-352.
Silva, W. R. y J. Vielliard. 2000. Avifauna de Mata Ciliar. Pp. 169-185. En: Ribeiro Rodríguez, R. y H. De Freitas Leitao Filho (Eds.): Matas Ciliares: Conservaçao e Recuperaçao. Ed. Univers. de Sao Paulo. Sao Paulo.
Vuilleumier, F. 1993. Biogeografía de aves en el Neotrópico: jerarquías conceptuales y perspectivas para futuras investigaciones. Revista Chilena de Historia Natural: 66: 11-51.