Algunas Ardeidas del valle de inundación del Río Paraná: Consideraciones sobre el nicho ecológico y mecanismos de aislamiento
Adolfo H. BELTZER 1, Martin A. QUIROGA 2 y Juan A. SCHNACK 3
1 Investigador del CONICET, Intituto Nacional de Limnología (INALI - CONICET - UNL) José Maciá 1933, 3016 Santo Tomé, Santa Fé. - E-mail: adolfohec2001@yahoo.com.arAbstract: CONSIDERATIONS ON ECOLOGIC NICHE AND ISOLATING MECHANISMS OF SOME ARDEIDAE SPECIES IN THE ALLUVIAL VALLEY OF PARANA RIVER. Herons are one of the best represented families in the flood plain of the Paraná River (10 species). That the interspecific competition constitutes the most significant factor in resources distribution is a prevailing idea in the ecological theory. According to recent studies, it has been shown that even though competition is important, the modelling of the communities structure results from the combined action of other factors which sporate independently of the interspecific interaction. The distribution of resources is closely related to the ecological niche concept, this being the quantitative description of the organic unity requirements. It is hypothesized in our work that the four studies species: Casmerodius albus (Great Egret), Egretta thula (Snowy Egret), Butorides striatus (Striated Heron) and Nycticorax nycticorax (Black-crowned Night Heron), their sympatry being observed, have developed adaptative mechanisms of ecological segregation. This let them use the resources in such a way that their diet composition (trophic subniche) and other parameters of their ecological requirements (temporal and spatial subniche) are differentiated. The index of relative importance IRI (Pinkas, et al., 1971) was applied to calculate the contribution of each food category to each species diet. The trophic overlapping of the alimentary spectra was determined by using the percentage of similarity according to Colwel and Futuyma (1971). The accumulated trophic diversity was calculated following the Hurtubia criterion (1978), the minimum sample for each species being then obtained. The feeding efficiency was measures by means of Acosta Cruz equation (1988) and to evaluate the feeding selectivity. Spearmans range correlation (rs) was employed. The trophic spread of the niche was estimated through Levins equation (1968). The spatial subniche evaluation was achieved with the index of habitat preference (Pi) according to Duncan (1983), whereas the mean index of fullness by Maule and Horton (1984) was applied to determine temporary dimension evaluation. As regards trophic spectrum even though fishes were found to be the basic diet for al four species and insects the second food category, slight differences exist between them which would establish mechanisms at the catches level. This is reinforced by the low overlapping values obtained and the lack of significance in the selectivity values. Variations concerning temporal and spatial subniches were also obtained. Summarizing, the coexistence in mainly based on the differential utilization of the resources as basic isolation mechanisms and lezz subtly on space and time. Without leaving aside the usefulness of further research, we think these results provide valuable data for the understanding of the Paraná complex system dynamics.
Key words: Birds - Feeding Ecology - Parana River.
Palabras clave: Aves - Ecología alimentaria - Río Paraná.
Introducción
Actualmente se conocen más de 9000 especies de aves en todo el mundo las que a lo largo del proceso evolutivo han colonizado los más diversos ambientes. Aunque según Maitland (en Martínez, 1993), pocas aves pueden ser consideradas como completamente acuáticas, aproximadamente ocho de los 28 órdenes actuales (Ziswiler, 1980) presentan adaptaciones morfológicas y fisiológicas relacionadas con su vida en ambientes acuáticos. De este elenco, se reconocen especies que simplemente se alimentan de peces, pero no tienen notables adaptaciones a la vida acuática, como los martín pescadores (Beltzer y Oliveros, 1987) y gavilanes pescadores, hasta aquellas especies que como los macaes construyen nidos flotantes y raramente salen del agua (Beltzer y Oliveros, 1982; Beltzer, 1983).
Las garzas (Ardeidae) aves acuáticas no zambullidoras, han cambiado mucho menos en apariencia. Sus principales cambios externos se expresan en el alargamiento relativo de las patas y el pico y su gran capacidad de vuelo, lo que las ha habilitado para explorar diversos cuerpos de agua someros y temporales. Para las aves, los cuerpos de agua son ecológicamente más simples que el medio terrestre pues en este último la temperatura ambiente y la disponibilidad del agua cambian con la latitud, altitud sobre el nivel del mar, presencia y tipo de vegetación, clima y otros factores. En contraste, el medio acuático presenta sólo dos alternativas básicas: el agua dulce y el agua de mar, siendo además menos fluctuante. El medio dulciacuícola provee de recursos a muchas especies eminentemente terrestres de muy distintos linajes que utilizan estos ambientes de diferentes formas. Por ejemplo, los insectos asociados a los cuerpos de agua son el alimento de un gran número de aves. Numerosos playeros explotan los fondos someros y fangosos. De esta manera la avifauna asociada a los cuerpos de agua dulce es mucho más compleja que el conjunto de especies estrictamente acuáticas.
Entre las especies de un mismo gremio existe mayor similitud morfológica y ecológica. Claramente los gremios son subconjuntos de comunidades y así se podrían distinguir varios de ellos desde el punto de vista del regímen alimentario: aves pescadoras, insectívoras, herbívoras y caracoleras. Como en cualquier otra clasificación artificial se presentan casos en los cuales una misma especie pertenece a mas de un gremio, tal el caso de las aves que se alimentan de peces e insectos (Morales, 1992).
El conocido principio de la exclusión competitiva (Cabrera, 1932; Hutson, 1979, 1981) enuncia en su forma más simple que, en ambientes poco cambiantes dos o más especies con requerimientos ecológicos similares (tales como el tipo de alimento, sitios de nidificación, refugio, etc.) no podrían convivir indefinidamente, puesto que tarde o temprano la especie competitivamente superior sería la única en sobrevivir. En tal sentido, a medida que en un ambiente dado hay más individuos de una o ambas especies, aumentaría la intensidad de la competencia. La acción de la competencia en una comunidad es más probable entre especies similares entre sí, es decir entre especies de un mismo gremio. Cabría preguntarse si existe una marcada competencia entre las mismas y aún si es posible la eliminación competitiva de alguna de ellas.
En primer lugar las aves acuáticas explotan usualmente ambientes inestables o fluctuantes a lo largo del ciclo y entre distintos años. En segundo lugar, a la vez que inestables, estos ambientes son de alta productividad y finalmente, en estas especies se observan generalmente mecanismos de partición de los recursos, aislamiento ecológico, especialización ecológica parcial, capturas de presas de diferentes tamaños, tipos y formas distintas, a diferentes horas del día y en distintos microhabitats.
Estos mecanismos son producto de la evolución conjunta en los hábitats que actualmente comparten, pero también reflejan preadaptaciones ya adquiridas en su lugar de origen en el caso de las especies de más reciente llegada a nuestro continente (Southwood, 2003).
Un factor adicional que también posibilita la coexistencia de las aves acuáticas es la gran diversidad de presas que pueden hallar. Potencialmente cada una de las especies difiere de las demás en cuanto a su capacidad visual, horas de actividad, conducta de escape, abundancia en el año, profundidad en la cual vive, etc. y responderá en forma diferente ante este mosaico de posibilidades.
Las aves pescadoras constituyen posiblemente el gremio más complejo de la comunidad de aves acuáticas. En muchas especies el término pescador no implica una dieta exclusivamente ictiófaga, puesto que frecuentemente capturan además una cantidad apreciable de insectos, camarones, cangrejos, arácnidos, etc. Entre las aves pescadoras, las zancudas forman una serie continua de especies de forma parecida, cuya mayor variación se expresa en el tamaño corporal. Casi todas capturan sus presas mientras caminan o acechan paradas sobre el fondo de los cuerpos de agua. Así la profundad de alimentación en cada caso está limitada por la longitud de las patas. En este grupo también se observa una secuencia en el tamaño del pico y el peso corporal, de manera que las especies de mayor tamaño o peso pueden capturar e ingerir presas más grandes. Asimismo, las aves de mayor tamaño se desplazan a menor velocidad mientras localizan a sus grandes presas e incluso pueden permanecer estáticas durante horas hasta el momento de la captura. En cambio, por lo general, las garzas pequeñas y medianas son más móviles y rápidas. A partir de la formulación del concepto de nicho ecológico publicado por Grinnel en 1904 (Levins, 1968) numerosos han sido los trabajos que desde diversos ángulos han analizado su real acepción. En 1958 la teoría del hipervolumen de Hutchinson postula una nueva concepción del nicho susceptible de cuantificación (Acosta, et al., 1990). Según esta teoría la coexistencia de especies en un habitat esta estructurada según su nivel de segregación a lo largo de diversas dimensiones del espacio ecológico en el cual se desenvuelven. Dentro de ese espacio ecológico juegan un papel de suma importancia las relaciones que se establecen alrededor de los recursos tróficos.
En este sentido, las evidencias obtenidas en estudios sobre la biología alimentaria de las aves corroboran ampliamente las proposiciones teóricas planteadas (Root, 1967; Cody, 1968) y demuestran que tanto los tipos de presa como su tamaño y la forma y eficiencia de captura, todos relacionados con la morfología del ave son variables fundamentales en el estudio de la dimensión trófica del nicho y de las relaciones tróficas entre las especies de un gremio (Cody, 1974; Eckhardt, 1979; Jordano, 1981). Las aves son destacados consumidores de los sistemas acuáticos (Martinez, 1993), siendo de gran importancia en este sentido la interrelación entre su tamaño corporal, requerimientos energéticos y niveles de actividad (Margalef, 1983). Por otra parte, pueden obtener su alimento en diferentes unidades de ambiente del sistema acuático (utilización espacial diferencial del ambiente o ecoespacio, Dobzhansky, et al., 1983) pudiendo explotar los recursos a lo largo del ciclo anual y a diferentes horas del día(modelos diferenciales de actividad temporal) (Pianka, 1982, Martínez, 1993). Teniendo en cuenta lo señalado por Begon et al., (1988) la asociación habitual entre la coexistencia de competidores y la diferenciación de los nichos ha conducido a muchos investigadores a buscar pruebas de la competencia en la distinción de diferencias de nichos de las especies en estudio a campo tal como lo ha hecho Lack (1971). En el campo de la ecología acuática continental los peces han sido en general los únicos vertebrados considerados de importancia limnologica (Martínez, 1993). Exceptuando a Margalef (1983), la mayoría de los tratados de limnología (Hutchinson, 1967; Wetzel, 1981; Cole, 1988) sólo hacen alguna breve referencia al papel de las aves en los sistemas acuáticos continentales.
En la teoría ecológica ha prevalecido la idea de que la competencia interespecífica constituye el factor de mayor incidencia en la partición de recursos (Roughgarden, 1983; Schoener, 1983). Estudios recientes desarrollados en nuestro medio han demostrado que si bien la competencia es importante, otros factores que operan independientemente de las interacciones interespecíficas actúan en forma conjunta en el modelado de la estructura comunitaria (Basso, 1990).
Si bien para algunos el término nicho debería ser eliminado, para otros debería indicarse cuál es la connotación que se le da (Remmert, 1988). Desde luego que desde Elton a nuestros días la interpretación de su significado ha tenido diferentes acepciones. Actualmente se designa con el término nicho la descripción cuantitativa de las exigencias de una unidad organísmica (población especie) en un sistema y con este criterio se enfocará el presente estudio. La partición de recursos está íntimamente vinculada al concepto de nicho ecológico. Debido a que este concepto es en la práctica inaplicable, ha sido común que en estudios sobre el papel funcional desempeñado por las unidades organísmicas se seleccionaran tres dimensiones principales: alimento, espacio y tiempo (Pianka, 1973, 1975, 1982). Esto ha dado lugar a lo que Giller (1984) denominara superposición diferencial de los nichos por la cual cuando especies similares se superponen en una dimensión están sustancialmente separadas en otra. En base a lo expuesto y a la falta de antecedentes de estudios que encaren un análisis global de las interacciones entre especies de aves de un gremio del valle de inundación del Paraná, se analizan los mecanismos que facilitan la segregación de los subnichos trófico, espacial y temporal entre las especies de la Familia Ardeidae al entender que estas aves, tal como lo expresara Amat (1984) permiten documentar las respuestas a las fluctuaciones ambientales. La literatura mundial es muy rica en estudios sobre la ecología trófica de las garzas, pudiendo citarse entre otros a Kahl, 1964; Kushlan, 1976 a-b, 1978; Watmough, 1978; Whitfield y Cyrus, 1978; Tosi y Toso, 1979; Amat y Soriguer, 1981; Kushlan, 1981; Forbes, 1987; Rohwer, 1988; Amat y Aguilera, 1989; Frederick y Collopy, 1989; Marion, 1989; Wolf y Jones, 1989; Frederick et al., 1990; Marquis y Leitch, 1990; Erwin et al., 1991; Gibbs, 1991; Kersten et al., 1991; Robinson y Groebner, 1991; Shealer y Kress, 1991; Giraudo y Beltzer, 1992; Lopez-Ornat y Ramo, 1992; Mora, 1992; O’Connor, 1993). Las especies consideradas en este estudio son las siguientes: Casmerodius albus (garza blanca), Egretta thula (garcita blanca), Butorides striatus (garcita azulada) y Nycticorax nycticorax (garza bruja).
Area de estudio
Esta investigación se llevó a cabo en la isla Carabajal, Santa Fe, Argentina, (31 39' S - 60 42' W) cuya superficie es de aproximadamente cuatro mil hectáreas. En ella se destacan numerosos cuerpos de agua leníticos, algunos de considerable extensión, tales como la laguna La Cuarentena de 150 hectáreas, laguna La Cacerola de 80 hectáreas, laguna La Vuelta de Irigoyen de 70 hectáreas y laguna El Puesto de 40 hectáreas. Esta isla pertenece a la unidad geomorfológica denominada llanura de bancos (Iriondo y Drago, 1972). La identificación y delimitación de losa ambientes se efectuó mediante el empleo de fotografías aéreas, y su posterior reconocimiento a campo y verificación de la fotointerpretación. Las grandes unidades de vegetación y ambiente insular (GUVA) han sido separadas según los criterios y terminología de contribuciones realizadas para el río Paraná (Beltzer, 1981, 1983a-b-c-d, 1984a-b, 1985, 1990a-b, 1991; Neiff, 1975, 1986a-b; Beltzer y Neiff, 1992). Para este estudio se han considerado las siguientes unidades de ambiente:
1. AGUAS ABIERTAS. Comprende el espejo de agua libre de vegetación.
2. VEGETACION ACUATICA FLOTANTE Y ARRAIGADA. Estas consocies ocupan
grandes extensiones cuyas variaciones dependen del ciclo hidrológico (Neiff, 1975, 1979, 1986). Las especies mas frecuentes y abundantes son Eichhornia crassipes, E. azurea, Azolla sp.., Salvinia sp., Pistia striatotes, Paspalum spp., Echinochloa sp., Ludwigia peploides, Polygonum spp.
3. BOSQUE EN GALERIA. Siguiendo el curso de los ríos y los diques marginales de los derrames laterales producidos por las crecientes, se halla generalmente el bosque en galería o monte blanco (Beltzer y Neiff, 1992). Las especies típicas son Salix humboldtiana y Tessaria integrifolia propias de los albardones incipientes, en tanto que en aquellos más altos se registran la presencia de otras especies como Erythrina crista-galli, Nectandra falcifolia, Cathronion polyantum, Sapium haematospermun, y además presentan pastizales con Bacharis sp., Sida rombifolia, Aspilia silphioides y otras, enredaderas como Ipomea sp., Muehlembeckia sagitifolia, Mikania micranta y estrato herbáceo con dominancia de gramíneas bajas.
4. PAJONAL. El ambiente de vegetación palustre tiene a Panicum prionitis como especie dominante, pudiendo observarse además facies de Scirpus californicus y de Typha spp. en ambientes conocidos como bañados (Neiff y Orellana, 1972).
5. PASTIZAL. Formación herbácea de contacto entre la selva en galería y el pajonal (Beltzer y Neiff, 1992), caracterizado por gramíneas bajas que se prestan al ramoneo del ganado presente en el área de estudio, inundable por períodos menores que seis meses.
6. MONTE. En los albardones altos y arenosos la vegetación típica está constituida por poblaciones arbóreas como Acacia caven, Erythrina crista-galli, Nectandra falcifolia, Sapium haematospermum, Croton urucurana y otras (Neiff y Orellana, 1972). Para este ambiente puede distinguirse el estrato inferior que corresponde a la vegetación herbácea, un estrato arbustivo y uno o dos estratos arbóreos.
7. PLAYA. Ocupa una reducida extensión en el Paraná y sus tributarios principales por la magnitud de los pulsos hidrosedimentológicos. Su existencia esta restringida a bajantes pronunciadas que dejan al descubierto extensos bancos de arena en islas del cauce o anillos perimetrales concéntricos en las lagunas del valle de inundación (Beltzer y Neiff, 1992).
Material y Métodos
Para los estudios del espectro trófico los ejemplares fueron capturados con arma de fuego (escopeta calibre 16). Se tomó peso del ejemplar, hora de captura, unidad de ambiente. Los estómagos fueron fijados en formol al 10% para el posterior análisis cuali-cuantitativo. Con el objeto de determinar la contribución de las diferentes categorías de alimento a la dieta de cada una de las ardeidas, se aplicó un índice de importancia relativa (IRI) (Pinkas et al., 1971):
IRI = %FO (%N + %V)
donde FO es el porcentaje de frecuencia de ocurrencia de una categoría de alimento, N es el porcentaje numérico y V el porcentaje volumétrico.
La determinación de la superposición de los espectros alimentarios fue medida a través del porcentaje de similaridad según Colwel y Futuyma (1971)
siendo Cih el solapamiento proporcional del nicho y pj la importancia de la especie j en la dieta de la especie i y h respectivamente.
Con el objeto de determinar la diversidad trófica se siguió el criterio de Hurtubia (1978) y que consiste en calcular la diversidad (H) para cada individuo utilizando la fórmula de Brillouin (1965):
donde N es el número total de organismos hallados en el estómago de cada individuo y Ni es el número total de presas i en cada estómago. Las estimaciones individuales fueron sumadas al azar obteniéndose la diversidad trófica acumulada (Hk).
La eficiencia alimentaria fue medida siguiendo el criterio de Acosta Cruz et al. (1988):
La selectividad dietaria se evaluó aplicando la correlación de rangos de Spearman (rs) (Schefler, 1969; Sokal y Rohlf, 1979).
donde X es el rango de abundancia de la presa hallada en el estómago siendo Y el rango ordinal de abundancia de la presa en el medio según evaluación cualitativa y n el número de especies presa. El resultado fue docimado en busca de significación según la siguiente ecuación:
donde r es el coeficiente de correlación obtenido.
Se consideraron los grados de participación trófica de las especies estudiadas en cada una de las
unidades de ambiente descriptas. Los porcentajes se obtuvieron considerando los taxa que componen
el espectro trófico hallado y el hábitat correspondiente a cada uno de ellos. Para la determinación del
hábitat de cada organismo componente del espectro trófico se emplearon trampas ubicadas en los
diversos ambientes organizándose una colección de referencia, habiéndose tenido en cuenta los
rasgos biológicos reconocidos en cada organismo presa.
La amplitud trófica del nicho se midió según la ecuación de Levins:
donde pij es la proporción del item i en la muestra j.
Se establecieron los grados de fidelidad que señalan la intensidad o frecuencia con que la especie se encuentra incluida en las unidades de ambiente y se expresan en función de los valores de ocurrencia obtenidos según la ecuación oportunamente formulada (Beltzer, 1984, 1986):
FO = Xt . 100 / Xe
donde Xe es el número de observaciones con presencia de la especie y Xt es el número total de observaciones.
Con el objeto de testear los valores de fidelidad obtenidos se empleó el índice de preferencia a las unidades de ambiente según el criterio de Duncan (1983)
Pi = log / Vi/Ai / + 1
donde Vi es el porcentaje de individuos registrados en cada unidad de ambiente y Ai es el porcentaje de cobertura correspondiente a cada GUVA. De este modo, los valores superiores a 0,3 indican alta preferencia por una determinada GUVA en tanto que los valores inferiores señalan una menor selectividad (Bignal, et al. 1988).
El ritmo circadiano de actividad alimentaria (dimensión temporal del nicho) se calculó el índice medio de saciedad (Index of Fullnes-IF) (Maule y Horton, 1984), considerando el volumen de los contenidos estomacales en cc sobre el peso del cuerpo del ave en g para cada tiempo de captura,
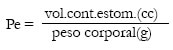
Resultados
Indice de Importancia Relativa - IRI
• Casmerodius albus (Gmelin, 1782) Garza blanca (n= 25)
La contribución de cada categoría de alimento a la dieta de esta especie obtenida por la aplicación
del índice de importancia relativa arrojó los siguientes valores: Peces = 17.600 Insectos = 1273
Arácnidos y Crustáceos = 85 (Fig. 1).
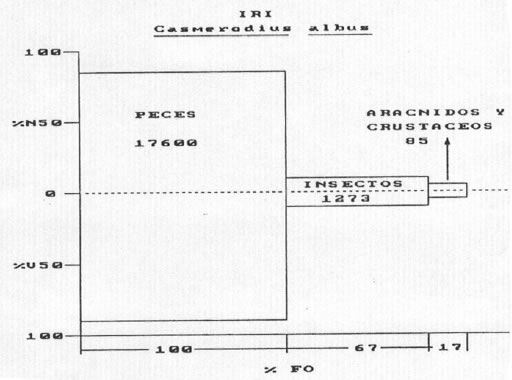
Fig. 1 Casmerodius albus. Indice de importancia relativa (IRI). %N= porcentaje numérico; %V= porcentaje volumétrico; F= frecuencia de ocurrencia.
Los peces estuvieron representados por 18 taxa y comprendieron adultos de especies de pequeña talla (hasta 125 mm de longitud total) y juveniles (entre 70 y 130 mm) de aquellas de mayor tamaño tales como Prochilodus lineatus, Pimelodus albicans, Leporinus obtusidens y Serrasalmus spilopleura. Estos constituyeron la mayor parte del alimento tanto en número como en volumen. Entre los insectos se observaron algunas formas aéreas y terrestres tales como odonatos (adultos), himenópteros y ortópteros. La presencia de un volumen muy bajo de la fracción vegetal tuvo un elevado porcentaje de ocurrencia, aunque su ingestión fue considerada accidental. La hepática Ricciocarpus natans fue la especie mejor representada especialmente en los casos en que formara densas coberturas en los sitios de alimentación donde fue capturada el ave. Los Curimatidae fueron los peces exhibieron mayor frecuencia y numerosidad.
El tamaño de las presas varió entre 5 y 130 mm, observándose una mayor preferencia por los peces que superaron los 20 mm. Entre los organismos acuáticos ingeridos predominaron aquellos asociados a la vegetación acuática. La mayoría de los peces identificados son típicos de la vegetación acuática tales como Brachyhypopomus brevirrostris y Apistogramma commbrae. Otros en cambio frecuentan preferentemente las aguas abiertas, como los Curimatidae y Apereiodon affinis (Beltzer y Oliveros, 1981).
• Egretta thula (Molina, 1782) Garcita blanca (n= 21)
Los valores del índice de importancia relativa obtenidos fueron los siguientes: Peces = 10.764
Insectos = 4758 Crustáceos = 11 (Fig. 2)
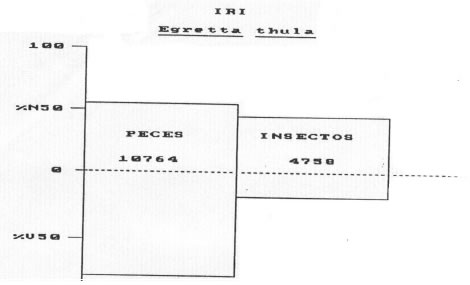
Fig. 2 Egretta thula. Indice de importancia relativa (IRI). %N= porcentaje numérico; %V= porcentaje volumétrico; F= frecuencia de ocurrencia.
La mayoría de los organismos fueron acuáticos, pero se registraron algunas formas aéreas de insectos, tales como odonatos y dípteros. Los peces estuvieron representados por 21 especies, en general de pequeño tamaño (hasta 60 mm de longitud), registrándose además juveniles entre 35 y 80 mm de Synbranchus marmoratus, Hoplias malabaricus y Schizodon borelli.
Los peces, fueron asimismo, los organismos más importantes tanto en numerosidad como en volumen y frecuencia de ocurrencia. Los Characidae fueron capturados con mayor frecuencia. La longitud de las presas varió entre 6 y 80 mm. La generalidad de los organismos acuáticos ingeridos tanto peces como insectos son formas asociadas a la vegetación acuática, si bien entre los primeros Astyanax bimaculatus y Cyphocharax platanus frecuentan preferentemente las aguas abiertas, en tanto que Odontostilbe pequira, Hyphesobrychon anisitsi y Odontostilbe paraguayensis, entre otras, pueden ser capturadas además en la vegetación acuática (Cordiviola de Yuan, 1980).
• Butorides striatus (Vieillot, 1817) Garcita azulada (n= 45)
La contribución de cada categoría de alimento obtenida por la aplicación del IRI arrojó los siguientes valores: Peces = 7548 Insectos = 4042Arácnidos = 286 Crustáceos = 168 Anfibios = 52
(Fig. 3).
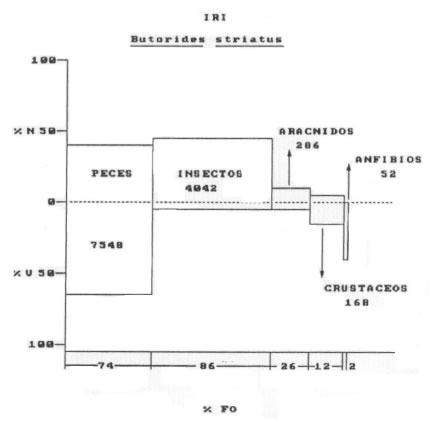
Fig. 3 Butorides striatus. Indice de importancia relativa (IRI). %N= porcentaje numérico; %V= porcentaje volumétrico; F= frecuencia de ocurrencia.
Los peces estuvieron representados por 16 especies cuyo rango varió entre 20 y 150 mm. Estos organismos constituyeron el alimento más importante y en su mayoría pertenecen a aguas poco profundas y asociadas a la vegetación acuática. La familia Characidae fue la que registró el mayor número de especies siendo ellas Odontostilbe pequira, Prionobrama sp., Astyanax sp. y Salminus brasiliensis. Los insectos estuvieron representados en su mayoría por formas acuáticas, principalmente hemípteros del género Belostoma, coleópteros y larvas de quironómidos; además se hallaron odonatos, dípteros (Muscidae) y ortópteros. Los restantes grupos del espectro trófico estuvieron escasamente documentados tanto en número, como en volumen y frecuencia de ocurrencia. Los arácnidos correspondieron a Pisauridae y Lycosidae, los crustáceos a Trychodactillus borelianus, Macrobrachium borelli y Hyalella curvispina y los anfibios a Leptodactylidae. Asimismo se registraron, semillas y restos de macrófitas correspondientes a Polygonum sp., Azolla sp. y Salix humboldtiana cuya ingestión se consideró accidental coincidiendo con la captura de las presas. En lo referente al tamaño de las presas, las mismas estuvieron comprendidas entre 10 y 200 mm, en tanto que la mayor frecuencia de captura se observó entre 10 y 50 mm. Las presas de menor tamaño correspondieron a los insectos (Curculionidae, Notonectidae y Belostomidae) y las de mayor talla a los peces con Eigenmania virescens de 150 mm y un anfibio de 200 mm.
• Nycticorax nycticorax (Gmelin, 1789) Garza bruja (n= 32)
Los valores del IRI obtenidos fueron los siguientes: Peces = 9890 Insectos = 1092 Crustáceos =
684 Anfibios = 380 Moluscos = 6 (Fig. 4)
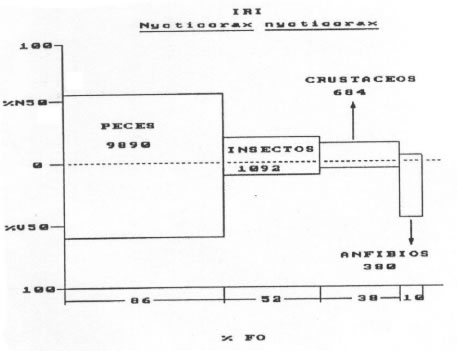
Fig. 4. Nycticorax nycticorax. Indice de importancia relativa (IRI). %N= porcentaje numérico; %V= porcentaje volumétrico; F= frecuencia de ocurrencia.
Los organismos más importantes fueron los peces, representados en algunos casos por ejemplares juveniles de Leporinus obtusidens, Pimelodus clarias, Hoplias malabaricus e Hypostomus sp., en tanto que de Synbranchus marmoratus se hallaron ejemplares adultos. El tamaño de las presas varió entre los 12 y 45 mm y los segundos entre los 38 y 330 mm. Las familias de peces numéricamente más importantes fueron Pimelodidae y Synbranchidae, siguiéndole con valores más bajos los Characidae y Loricaridae. Los Synbranchidae, con su única especie Synbranchus marmoratus fueron los más numerosos y frecuentes.
Solapamiento de las dietas
La comparación de las dietas de las cuatro especies por pares permitió determinar su similaridad y grados de solapamiento. La relación trófica más importante se dio en el par Egretta thula/Butorides striatus con un valor de 35% de solapamiento. Por otra parte, los pares restantes, Casmerodius albus/ Egretta thula; Butorides striatus/Nycticorax nycticorax y Egretta thula/Nycticorax nycticorax obtuvieron valores menores y comparativamente similares de superposición 20%, 19,3% y 19% respectivamente. En orden de importancia le siguió el par Casmerodius albus/Nycticorax nycticorax con un 15%, en tanto que el valor más bajo registrado correspondió al par Casmerodius albus/Butorides striatus con un 2%.
| E.thula | B. striatus | N. Nycticorax | |
| C. albus | 20 | 2 | 15 |
| E. thula | - | 35 | 19 |
| B. striatus | - | - | 19.3 |
Amplitud del nicho trófico
En lo que hace a la equiparidad estacional de la dieta de las garzas medida a través de la amplitud del nicho trófico se obtuvieron los siguientes valores:
| Primavera | Verano | Otoño | Invierno | |
| C. albus | 3.86 | 5.57 | 2.94 | 3.95 |
| E. thula | 2.83 | 3.03 | 7.39 | 4.48 |
| B. striatus | 6.17 | 14.92 | - | - |
| N. nycticorax | 6.62 | 5.84 | 3.55 | 4.97 |
La falta de valores correspondientes a otoño e invierno para B. striatus se debe a su condición de especie migratoria, cuya presencia en el área se observa en la primavera y verano.
Diversidad trófica
El método de representar gráficamente la curva de diversidad trófica acumulada en relación al número de estómagos analizados permite observar el punto en el cual dicha curva comienza a estabilizarse. El comienzo de la asíntota representa la muestra mínima. Las muestras mínimas correspondientes a cada una de las cuatro especies estudiadas se representan en las figuras 5, 6, 7 y 8.
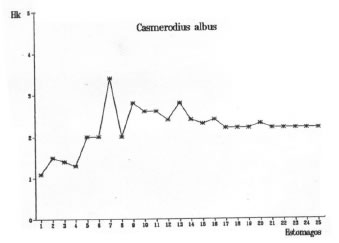
Fig. 5. Casmerodius albus. Diversidad trófica acumulada (Hk).
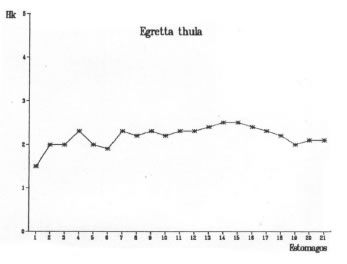
Fig. 6. Egretta thula. Diversidad trófica acumulada (Hk).
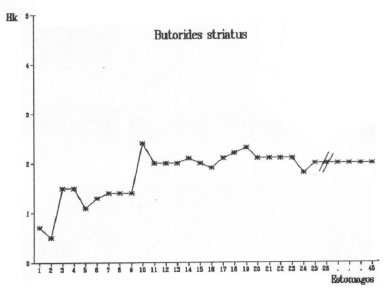
Fig. 7. Butorides striatus. Diversidad trófica acumulada (Hk).
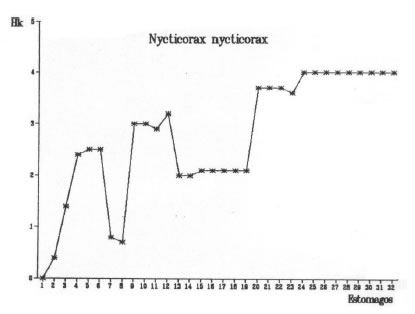
Fig. 8. Nycticorax nycticorax. Diversidad trófica acumulada (Hk).
Eficiencia alimentaria
En lo referente a la eficiencia alimentaria (Acosta Cruz, et al., 1988) los valores registrados fueron los siguientes:
| Primavera | Verano | Otoño | Invierno | |
| C. albus | 99,31 | 99,11 | S/D | 99,0 |
| E. thula | 98,03 | 99,01 | 98,2 | 99,0 |
| B. striatus | 97,8 | 92,3 | - | - |
| N. nycticorax | 99,00 | 98,64 | 95.00 | 99.8 |
Selectividad dietaria
El cálculo del índice de correlación de rangos de Spearman (rs), arrojó resultados no significativos según el siguiente detalle:
Casmerodius albus = rs = 0,082 P = 0,001
Egretta thula = rs = 0,30 P = 0,001
Butorides striatus = rs = 0,93 P = 0,001
Nycticorax nycticorax = rs = 0,21 P = 0,001
Grados de fidelidad a las unidades de ambiente
Tal como lo expresara Pianka (1982) las relaciones entre la eficacia biológica y el uso del espacio son normalmente complejas ya que los animales utilizan diferentes microhabitats para distintas finalidades y momentos del día. El área o volumen sobre el que una especie recorre durante el curso de sus movimientos diarios es el área de influencia o área de actividad (Wilson, 1980).
Los valores porcentuales obtenidos fueron los siguientes:
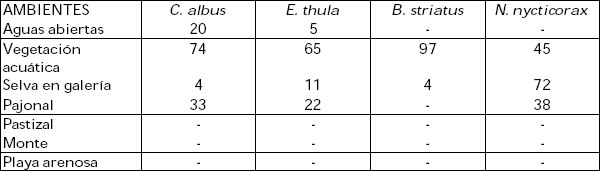
Teniendo en cuenta los resultados expuestos se puede observar que la unidad de ambiente más frecuentada por las garzas estudiadas es la vegetación acuática tanto flotante como arraigada con porcentajes que oscilan entre 45 y 97%. En este ambiente obtienen el alimento más importante representado por lo peces, siguiéndole en orden de importancia los insectos y otros itemes (Tabla 1). En particular C. albus y E. thula prefieren la vegetación flotante (Eichhornia sp., Azolla sp., Salvinia sp., Pistia sp.) en tanto que B. striatus muestra mayor fidelidad por la vegetación arraigada (Polygonum sp., Paspalum sp., Echinochloa sp.).
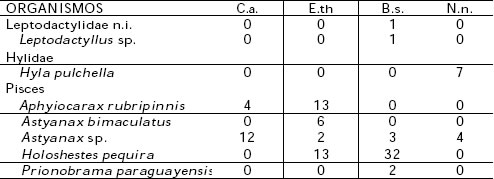
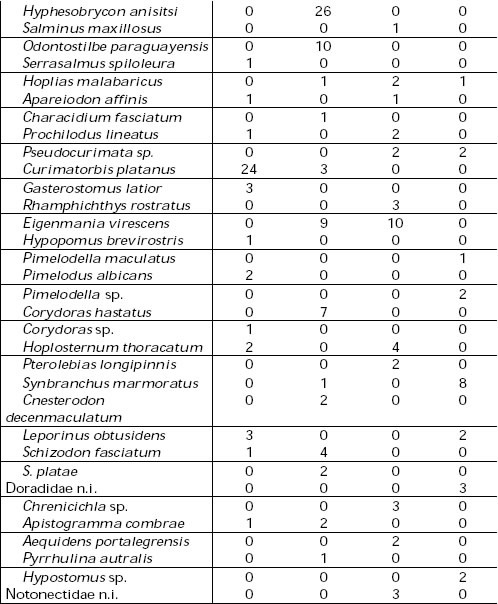
Tabla 1. Espectros tróficos de las especies estudiadas. C.a. = Casmerodius albus, E.th. = Egretta thula, B.s.= Butorides striatus, N.n.= Nycticorax nycticorax.
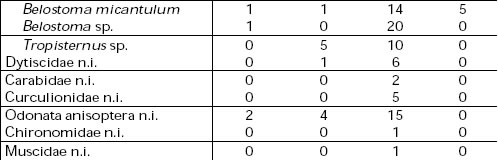
Con excepción de B. striatus el ambiente de pajonal es la unidad que le sigue en orden de importancia. Este ambiente es frecuentado en la búsqueda de alimento por C. albus y E. thula,particularmente en las fases de anegamiento anual o bianual (Beltzer y Neiff, 1992). Por su parte, N. nycticorax también hace uso del pajonal que utiliza como apostadero diurno aunque no debe descartarse su participación trófica en el mismo.
En tercer lugar se ubica la selva en galería con valores altos para N. nycticorax (72%) y muy bajos para las especies restantes. La utilización que la garza bruja hace de este ambiente está referida al reposo durante las horas del día en los estratos superior y medio según las características de esta formación arbórea. Por su parte C. albus, E. thula y B. striatus la utilizan para obtención del alimento particularmente en períodos de inundación. Este ambiente es, asimismo, empleado como apostadero nocturno en las horas de reposo y, en el caso de B. striatus también para la nidificación.
El ambiente de aguas abiertas constituye, si bien con valores bajos, el dominio de C. albus y E. thula siendo la longitud de las patas la adaptación estructural que le permite a la primera adentrarse más profundamente para la obtención del recurso.
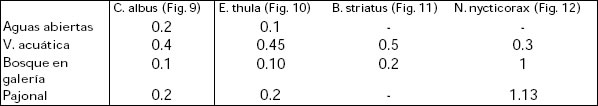
Todas las apreciaciones precedentes son coincidentes con los valores obtenidos con el índice de preferencia (Pi). Los valores obtenidos para las especies estudiadas fueron los siguientes:
Indice medio de saciedad
Tal como lo señala Schoener (1974) los nichos están diferenciados por la forma, el lugar y tiempo de utilización de los recursos.
En lo que hace al ritmo diario de actividad alimentaria, los resultados del índice de saciado (Index of Fullnes) permiten visualizar que no existe un patrón definido para C. albus y E. thula en lo que hace a la búsqueda del alimento (Figs. 13 y 14).
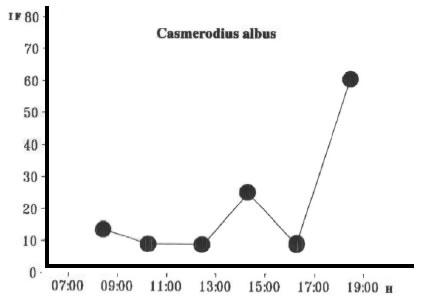
Fig. 13. Casmerodius albus. Indice Medio de Saciedad. H: Hora de Captura.
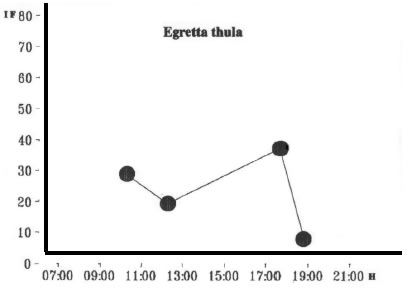
Fig. 14. Egretta thula. Indice Medio de Saciedad. H: Hora de Captura.
En cambio, B. striatus presentó un patrón que describe un ritmo circadiano en campana (Vides Almonacid, 1987) con un pico de actividad alimentaria entre las 12:00 y las 15:00. Estos resultados (Fig. 15) son coincidentes con las observaciones efectuadas en lugares de nidificación (Beltzer, 1991; Mosso y Beltzer, 1992) donde los individuos comienzan a desplazarse en las primeras horas del día y continuando activamente con vocalizaciones y vuelos hacia y desde los sitios de nidificación hasta el atardecer. Debe tenerse presente que B. striatus es una especie migratoria que desde su arribo al valle de inundación del río Paraná comienza de inmediato con la construcción de nidos y se reproduce hasta el mes de febrero-marzo para posteriormente emprender la migración.
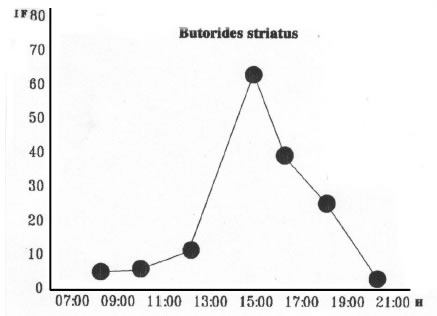
Fig. 15. Butorides striatus. Indice Medio de Saciedad. H: Hora de Captura.
N. nycticorax como garza de actividad crespuscular y nocturna presentó y patrón lineal decreciente (Fig. 16) lo que estaría indicando una activa participación trófica nocturna ya que los estómagos aparecen en estado de repleción en las capturas de las primeras horas del día (06:00 a 07:00); a partir de este momento el grado de digestión de las presas comienza a ser avanzado observándose estómagos vacíos hacia el medio día. Posteriormente se observa una tendencia a reiniciar la búsqueda del alimento hacia la hora 19:00.
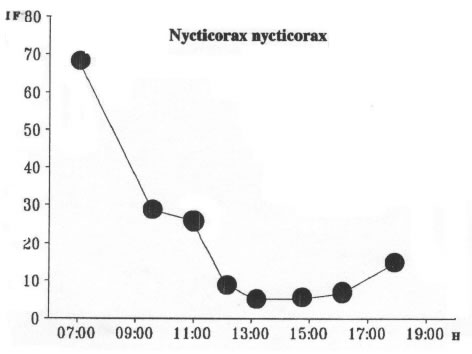
Fig. 16 Nycticorax nycticorax. Indice Medio de Saciedad. H: Hora de Captura.
Discusión
Indice de Importancia Relativa
En lo que se refiere a los espectros tróficos de las cuatro especies estudiadas (Tabla 1), los resultados del índice de importancia relativa (IRI) ponen en evidencia que los peces constituyen la dieta básica, en tanto que los insectos conforman la segunda categoría.
Los itemes restantes podrían señalarse como categorías secundarias de alimento o accesorios dado que los valores obtenidos son ostensiblemente menores.
Esta apreciación si bien válida en lo que hace a la importancia de cada categoría de alimento considerada a nivel de grandes grupos es coincidente con el estado de conocimientos de los escasos antecedentes en el área.
Los trabajos realizados hasta el momento, si bien válidos por su originalidad, resultan insuficientes dado que en general se basan en observaciones ocasionales, escaso número de ejemplares analizados y con un bajo nivel de precisión en lo que respecta a la resolución taxonómica del alimento.
La información mundial sobre la ecología alimentaria de estas especies es rica y en general es coincidente en lo que se refiere a los grandes grupos de organismos consumidos (Erwin, 1985; Ewins y Hennessey, 1993; Fasola et al., 1981a-b, 1993; Kushlan, 1976-b, 1978; Trexler, et al. 1994; Watmough, 1977; Wiggins, 1991).
Es evidente la existencia de sutiles diferencias entre estas competidoras potenciales las que establecerían mecanismos diferenciales a nivel de las presas. En lo referente al tamaño, si bien el rango de C. albus osciló entre 5 y 130 mm con una preferencia por las presas mayores de 20 mm, E. thula no manifestó tendencias claras en sus rangos y el tamaño varió entre 6 y 60 mm. Por su parte B. striatus el tamaño de las ingestas osciló entre 10 y 200 mm con una mayor ocurrencia por las presas entre 10 y 50 mm y N. nycticorax por su parte presentó un rango entre 12 y 330. De la comparación entre las cuatro especies, si bien se observan superposiciones en los tamaños, el valor máximo o la preferencia por una determinada longitud, pone en evidencia una relación entre la longitud del pico y el alimento ingerido. De esta manera C. albus llega a consumir organismos de hasta 130 mm, E. thula hasta 60 mm, B. striatus con preferencia por los de 50 mm y N. nycticorax hasta 330 mm. Por otra parte debe destacarse que cualitativamente se trata de itemes distintos y para esto debe recordarse los valores de superposición trófica hallados al utilizar la matriz del recurso según Colwel y Futuyma(1971). Desde varias décadas atrás hasta el presente (Lack, 1945) la información bibliográfica ofrece una rica información sobre este aspecto que hoy la fisiología ecológica intenta comprender al encarar estudios que vinculen las características fisiológicas y la plasticidad fenótipica que les conduce a la adaptación que en este caso se expresa básicamente en la composición de los espectros alimentarios Bozinovic, 1993).
Solapamiento de dietas
Teniendo en cuenta lo antes expuesto y considerando el solapamiento de las dietas por pares que ha permitido determinar la similaridad y superposición, surge una mayor coincidencia en la selectividad trófica en el par Egretta thula/Butorides striatus pese a exhibir un valor relativamente bajo (35%). Egretta thula tiene un espectro alimentario integrado por 25 entidades taxonómicas en tanto 30 en el caso de Butorides striatus, siendo Holoshestes pequira y Eigenmania virescens las especies de peces abundantes en el medio, las que son consumidas en mayor número por ambas garzas. Para los pares restantes los valores de solapamiento son ostensiblemente menores (20%, 19,3%, 19% 15% y 2%). Estos resultados sugieren que las cuatro especies de garzas estudiadas establecen un claro mecanismo en la dimensión trófica del nicho posibilitando su coexistencia. Algunos autores (Andrewartha y Birch, 1954; Bowman, 1961) han postulado la idea de desestimar a la competencia como un factor importante en la estructura de las comunidades. Sin embargo Begon et al. (1988) consideran que la competencia interespecífica puede desempeñar un papel central y poderoso en la configuración de las comunidades. En el pasado esta idea fue fomentada por el principio de la exclusión competitiva. En tiempos más recientes, la misma idea ha sido defendida con variantes más sofisticadas del mismo principio, tales como la similitud limitante y el empaquetamiento de los nichos. Estos conceptos proponen un límite a la similitud entre las especies que compiten y por consiguiente un límite en el número de especies que puedan estar situadas en una comunidad particular antes de que el espacio del nicho se encuentre saturado. Los resultados de Schoener (1983) y Connel (1983) parecen indicar que la competencia interespecífica es un fenómeno difundido, pero su porcentaje de aparición entre especies es relativamente ocasional. Para este caso, las garzas integrarían un sistema de competencia por explotación (Elton y Miller, 1954; Miller, 1967) en el cual consumirían un recurso sin reducir la probabilidad de que otros también puedan explotarlos. Este concepto puede vincularse al más recientemente de Margalef (1977) referido “competencia imperfecta”. En relación con lo expresado, Kufner, et al. (1992) en un estudio sobre relaciones tróficas en herbívoros determinaron superposiciones de hasta un 80%. Como lo señalaran Wiens y Rotenberry (1979), Jaksic et al. (1981) el solapamiento por sí solo no provee evidencia de competición en un medio natural sino que constituye, como ya se ha indicado, probabilidad de encuentro (Colwell y Futuyma, 1971).
Las mayores concentraciones de garzas, particularmente C. albus y E. thula se han observado en el área de estudio cuando se produce la limnofase. En este estado hidrológico, pequeños cuerpos de agua someros que durante la potamofase estuvieron conectados al río o a cuerpos leníticos permanentes, ofrecen a las garzas la posibilidad de explotar peces que han quedado atrapados y de no ser incorporados como alimento están condenados a morir por desecación. Kushlan (1976) señala que garzas y cigüeñas consumieron del número total de peces en una pequeña laguna de la Florida entre un 75 y 80 %. Los niveles de depredación con estas características son citas frecuentes en trabajos sobre ecología alimentaria de aves acuáticas del hemisferio norte e incluso para Colombia y Venezuela donde el contraste entre el período de sequías y lluvias es muy marcado (Ayarzaguena et al., 1981; Aguilera Prieto, 1988). En el Paraná la magnitud de su valle de inundación asegura a lo largo de todo el ciclo la disponibilidad de cuerpos de agua leníticos, cual es el caso de la isla Carabajal donde fue realizado este estudio. En el verano de 1985-1986 se registró una bajante extraordinaria, sin que esto afectara en forma manifiesta el espejo de agua de las lagunas más importantes.
Amplitud del nicho trófico
Si se considera la amplitud del nicho trófico a lo largo de las estaciones del año, se puede observar que en el caso de Casmerodius albus el valor más alto corresponde al verano (NB= 5,57) lo que está indicando que si bien están presentes muchas de las entidades taxónomicas su presencia está aminorada, lo que hace a la muestra de este período más homogénea. En contraste en primavera e invierno los valores son más bajos y semejantes (NB= 3,86 y 3,95 respectivamente) Esto se debería al registro de un item importante que en este caso correspondió en verano a Gasterostomus sp, y en invierno a un Curimatino (no identificado). El valor más bajo se observó en otoño (NB= 2,94) por la presencia de una ingesta mayoritaria representada por Curimatorbis sp.
Para el caso de Egretta thula el valor más alto se halló en otoño (NB= 7,39) con una muestra homogénea en lo que hace a la cantidad de itemes siguiéndole en orden de importancia el valor obtenido para el invierno (NB= 4,48) siendo Hyphesobrycon el organismo más importante numéricamente. Le siguieron en orden de importancia el verano (NB= 3,03) y la primavera (NB= 2,83) con dominancia de los peces para el verano en tanto que los insectos fueron los más abundantes.
Los valores de Butorides striatus corresponden solamente a primavera y verano ya que se trata de una especie migratoria cuyo arribo al área de estudio se produce en los primeros días de setiembre y permanece hasta el mes de abril aproximadamente (Beltzer, 1983-a; Mosso y Beltzer, 1992). Los valores hallados fueron NB= 6,17 para primavera y NB= 14,92 para el verano. La maximización de primavera se debió a la presencia mayoritaria de Holoshestes pequira y el alto valor del verano al notorio incremento del número de entidades taxonómicas del espectro trófico, maximizada por esta especie entre los peces y por los belostómidos y odonatos entre los insectos.
Con respecto a N. nycticorax con excepción del invierno (NB= 4,97), existe una equiparidad en las estaciones restantes (Verano= 5,84; Primavera = 6,62 y Otono = 6,55)
Selectividad dietaria
Los valores obtenidos con la aplicación de la correlación de rangos de Spearman (rs) permiten señalar que la selectividad dietaria no fue significativa para ninguna de las cuatro especies de garzas en estudio. Esto coincide con Jenni (1973) en el sentido de que las garzas son en general aves oportunistas respecto al alimento, de modo que sus espectros pueden variar ampliamente según las estaciones, condiciones generales y oferta de los recursos. Para Bozinovic y Merrit (1991) y Foley y Cork (1992) esta variabilidad ambiental que presentan los organismos, es una evidencia de la plasticidad que se expresa en los mecanismos de comportamiento, mecanismos anatómicos y fisiológicos.
Grados de fidelidad - dimensión espacial
En lo que se refiere a los grados de fidelidad a las unidades de ambiente del ecosistema acuático, C. albus y E. thula presentan una relación muy estrecha en lo que hace al uso del hábitat. La elevada fidelidad a estas guvas está vinculada al porcentaje de organismos acuáticos que componen su dieta. De lo expuesto y considerando que el valor obtenido en la aplicación del índice de similitud de Jaccard (Beltzer, 1981) se obtuvo un valor de 32%, el grado de preferencia es indicativo de un mecanismo de aislamiento en la dimensión trófica del nicho.
El área de B. striatus corresponde a dos guvas: vegetación acuática y selva en galería. Estos resultados son similares a los obtenidos para C. albus y E. thula con referencia al ambiente de vegetación acuática. Si estos resultados referidos a la dimensión espacial se confrontan con los correspondientes al solapamiento de dietas, B. striatus/E. thula exhibió el valor más alto. Si bien este valor es relativamente bajo se trataría del único par con alguna probabilidad de encuentro (Krebs, 1986). En cambio en el par B. striatus-C. albus el solapamiento fue de sólo el 2%, evidencia clara de un mecanismo de aislamiento en la dimensión trófica del nicho.
En lo que concierne a los grados de fidelidad el valor más alto de N. nycticorax fue de 72% correspondiendo al ambiente de selva en galería, siguiéndole en orden de importancia vegetación acuática (45%) y pajonal (38%). El valor de la selva en galería no guarda relación alguna con los patrones de conducta alimentaria ya que como se ha señalado las observaciones para este estudio fueron efectuadas en períodos de horas luz. Tal como se ha indicado en la dimensión temporal (ritmo circadiano) N. nycticorax es una garza de hábitos crepusculares-nocturnos, razón por la cual la utilización que hace del estrato arbóreo es el de reposo. Por su parte, si bien se han hallado ejemplares en el pajonal durante el día, tanto este ambiente como el de vegetación acuática son unidades que responden a sus requerimientos alimentarios. El espectro trófico hallado pertenece en gran medida a estos hábitats.
La utilización diferencial de los hábitats por las aves acuáticas ha sido documentada por numerosos autores (Mc Arthur, 1957, 1958;Lack, 1971; Stott y Olson, 1973; Weller, 1976; Siegfried, 1976;Margalef, 1977; White y James, 1978; Poysa, 1983; Madsen y Mortensen, 1987; Heimsath et al., 1993 entre otros). Estos antecedentes y las evidencias científicas y experimentales del presente estudio permiten fortalecer la idea de manifestarse coexistencia entre especies con requerimientos ecológicos similares. Por otra parte, el sistema del Paraná por sus características y valle de inundación sometido a pulsos impredecibles en su comportamiento hidrológico, determina la existencia de variaciones en las unidades de ambiente y como consecuencia en la heteroreneidad espacial (Beltzer y Neif, 1992).
Los resultados del índice de preferencia por las distintas GUVAS respaldan lo expuesto. Los valores superiores a 0,3 fueron similares para C. albus, E. thula y B. striatus en tanto que variaron para N. nycticorax donde las GUVAS con valores ostensiblemente mayores se registraron en el bosque en galería y pajonal. En este caso debe recordarse la actividad nocturna del ave. En este sentido, las capturas fueron efectuadas durante las horas luz cuando esta especie utiliza el bosque y el pajonal como apostaderos de descanso. Siguiendo la clasificación de Wilson (1980) para las cuatro especies de garzas, la GUVA vegetación acuática representaría el área nuclear, entendiéndose por ésta la zona de la que se hace mayor uso dentro del área de influencia o área de actividad. La riqueza extraordinaria de la fauna de vegetación acuática posibilita que las provisiones de alimento sean mayores favoreciendo un incremento de las tasas de supervivencia de las presas potenciales (Bell, et al., 1991).
Dimensión temporal
Por las características de su ritmo circadiano de actividad alimentaria, N. nycticorax establecería con las restantes especies estudiadas un claro mecanismo de aislamiento en la dimensión temporal del nicho. Estas observaciones son coincidentes con las observaciones de Beltzer y Oliveros (inéd.) al indicar hábitos nocturnos. Por otra parte su mayor actividad nocturna ha sido referida en la literatura específica (Hudson, 1974; Hanzak, 1968; Watmough, 1978; Saver, 1984). Este comportamiento queda avalado por la importancia numérica de Synbrancus marmoratus en la dieta, teniendo en cuanta que se trata de un pez notable porque respira igualmente bien en el agua y en el aire atmosférico. Utiliza las branquias primariamente para la respiración, pero las paredes de la cámara branquial están altamente vascularizadas y contribuyen al intercambio gaseoso. Cuando el pez está en el aire, la cámara branquial es hinchada periódicamente y el aire se retiene durante unos 10 a 15 minutos mientras que se extrae de él aproximadamente la mitad de su contenido en oxígeno. La hinchazón de la cámara branquial con el aire se sigue invariablemente por un aumento sustancial en el contenido arterial de oxígeno que se acerca a la saturación (Johansen, 1966; Schmidt-Nielsen, 1983). Según Hoar (1978), S. marmoratus repta con frecuencia sobre la hierba húmeda. El tipo de presa, la alta frecuencia y en algunos casos la abundancia de pequeñas plantas acuáticas flotantes son indicadoras que los sitios fueron preferentemente vegetados y el patrón de conducta alimentaria correspondió a la“alimentación de pie o al acecho” (“stand and wait”) o “caminando lentamente” (“walk slowly”) señalados por Kushlan, 1976; Watmough, 1978 y Bogliani, 1980.
En relación a las tres especies restantes, las observaciones y capturas que permiten evaluar su ritmo de conducta alimentaria fueron efectuadas desde el amanecer al atardecer. Esto es importante de destacar ya que referencias recientes mencionan para algunas especies que se consideraban de actividad diurna como las garzas que también se alimentan durante la noche (Powel, 1987; Jorde, 1988; Robert et al., 1989; Mc Neil, et al., 1992, 1993a-b, Mc Neil, et al. 1993a-b; Wiggins, 1991). Robert, et al. (1989) para N. nycticorax menciona una frecuencia de ocurrencia diurna del 93 % y nocturna del 38,2 % , en tanto que para las garzas del género Egretta 64,8 % para la actividad diurna y 7,8 % para la nocturna. Por su parte Scortecci (1969) observa para C. albus una actividad alimentara tanto de día como de noche. En esta investigación se ha observado que C. albus como E. thula comienzan a reunirse en bandadas al anochecer en gran número, utilizando como apostaderos las formaciones arbóreas próximas a los cuerpos de agua. Este patrón de conducta ha sido señalado por Bo y Darrieu (1993). Su agrupamiento para dormir señalado por Ward (1965) se basa en el concepto de imagen de búsqueda. En tal sentido Krebs (1974, 1978, 1985) indica que la localización de la posible calidad de un comedero puede atribuirse a la presencia de otros individuos posados para descender en búsqueda de alimento. Amstrong (1971) y Smith (1982) han sugerido que el plumaje blanco (C. albus y E. thula) ayuda a la unión de los miembros de una bandada en las zonas con disponibidad de peces. Por otra parte el crecimiento de la eficiencia en la búsqueda del alimento aumentaría al incrementarse la densidad de la población (Hassel, 1988) y contribuiría al retorno a áreas previamente explotadas (Blondel, 1986). Master, et al. (1993) al comparar varias especies de garzas entre ellas C. albus y E. thula hallaron diferencias en los valores de las tasas de eficiencia de captura siendo mayores en todos los casos los valores para individuos que se hallaban formando grupos en comparación con los solitarios. No obstante en C. albus y E. thula no presentaron un patrón definido a lo largo de las horas del día en que se efectuaron las capturas y observaciones. Para C. albus los patrones de conducta alimentaria serían de “pie o al acecho” (“stand and wait”) o “caminando lentamente” (“walk slowly”). Con este tipo de conducta la especie combina “pararse y esperar” antes de capturar la presa (Kushlan, 1976). Para esta especie debe considerarse además el patrón de “zambullirse con las patas primero” (“feet first diving”). Este comportamiento si bien no frecuente fue observado en 1980 cuando un grupo de aproximadamente 50 individuos capturó peces en aguas abiertas en vuelo, suspendiéndose momentáneamente en el aire o introduciendo sus patas en el agua al lanzar los picotazos. Esta conducta estuvo asociada a la captura de peces por parte de una bandada de Phalacrocorax olivaceus. Las capturas coincidían con las zambullidas de los biguaes, haciendo suponer que los peces ascendían al ser perseguidos, momento en que era aprovechado por las garzas (Beltzer, 1981). En el caso de E. thula y tal como lo indica Morales (1992) las garzas pequeñas se desplazan a mayor velocidad y de acuerdo con Jenni (1969) se le asigna el patrón de conducta “perseguidora” sin desechar el “acecho” o “caminando lentamente”.
Finalmente B. striatus presentó un ritmo de actividad en “campana” con un pico en las horas del medio día. Esta observación se contrapone a lo descrito por Bó y Darrieu (1993) quienes han señalado que esta especie prefiere alimentarse en las primeras horas de la mañana o al atardecer. El patrón de conducta para esta especie es “al acecho” situándose en las orillas vegetadas donde obtiene su alimento. Bo y Darrieu (1993) citan además el “caminar lentamente”. Tal como lo expresara Conlinvaux (1980) estos hábitos alimentarios constituyen un índice adaptativo de su fisiología, de sus habilidades mecánicas y de su conducta.
Conclusiones
Las especies de garzas estudiadas exhiben una distribución en parches, impredecibles en el tiempo y en espacio. La oferta de habitat está fuertemente condicionada por el régimen hidrosedimentológico pulsátil de cuyas características depende la oferta de habitat.
Ante las condiciones contrastadas entre crecientes y bajantes establecen en función de sus adaptaciones estructurales, comportamiento específico, diferenciación de dietas, áreas de explotación y ritmo diario de alimentación, los mecanismos de aislamiento que les permiten la coexistencia evitando de este modo la exclusión competitiva.
Por lo expresado se señala que los ambientes del valle de inundación del río Paraná constituyen un mosaico de habitats (GUVAS) favorables/desfavorables, representando parcelas que son asequibles temporalmente.
La versatilidad trófica de estas garzas, es la consecuencia de un diseño estructural que les posibilita la realización de distintos mecanismos de captura, permitiéndoles efectuar ajustes a los distintos tipos de presa. La señalada versatilidad trófica queda avalada por los resultados de las observaciones de los contenidos estomacales que han evidenciado un amplio rango de ítemes alimentarios.
La riqueza íctica del valle de inundación del río Paraná y otros taxa de su fauna, indican que las garzas como otras especies básicamente ictiófagas sean los componentes mas importantes de los ensambles de aves asociadas al ecosistema acuático.
Los amplios espectros tróficos les permiten suplementar las potenciales carencias de alimento en energía, reducir el tiempo de búsqueda y responder a cambios en la calidad de la dieta.
El solapamiento dietario es sólo evidencia de probabilidad de encuentro entre las especies estudiadas. Los valores hallados fueron ostensiblemente bajos y aun así no proveen evidencia de competición. Por lo tanto estos resultados son reveladores de un mecanismo de aislamiento en la dimensión trófica del nicho, que se manifiesta en la flexibilidad de la estereotipia del comportamiento en las técnicas de captura, el aumento de la talla corporal y la gama de unidades de ambiente.
Estas especies de garzas se hallan en definitiva, separadas por sus costumbres alimenticias (composición de los espectros), con un bajo solapamiento interespecífico de dietas, basado en líneas generales en un reparto eficiente de los subnichos tróficos y en una amplia diversidad de presas. Esto permite señalar que a pesar de su parecido, explotan recursos sutilmente distintos con diferencias espaciales (dimensión espacial) y circadiales (dimensión temporal).
En síntesis la coexistencia está basada en la utilización diferencial de los recursos como mecanismo básico de aislamiento y menos sutilmente en el espacio y tiempo.
En el caso de estas cuatro especies habría una complementariedad de nichos. Dentro del conjunto de aves de este gremio que obtiene su alimento caminando, la diferenciación afecta varias dimensiones y las especies que ocupan una posición similar a lo largo de una dimensión tienden a diferenciarse a lo largo de otra.
La interacción entre las diferentes especies de garzas, así como de otras especies, hacen de estos ambientes insulares del valle de inundación del río Paraná, un objeto de estudio de especial interés para el conocimiento de este sistema acuático. Estas investigaciones son consideradas de gran importancia ya que contribuyen a la conservación de la biodiversidad.
Asimismo, estas especies y tal como lo fuera señalado para las aves en general por el Common Bird Census, son indicadoras del estado de un ambiente. Por este motivo, son numerosos los países que han iniciado programas regulares para el control cuantitativo de las poblaciones y nuestro país no puede permanecer ajeno a estos emprendimientos.
Sin menoscabo de una ulterior profundización, estos resultados aportan datos que se consideran de valor para el conocimiento de la dinámica del complejo ecosistema del río Paraná. Es verdad que aún resta mucho por estudiar y esto no es sólo de interés para la ecología teórica sino que tiene gran importancia práctica para el manejo efectivo de los ecosistemas acuáticos.
Bibliografía
Acosta, M.; L. Mugica y P. Martínez. 1990. Segregación del subnicho trófico en seis especies de Ciconiformes cubanos. Ciencias Biológicas, 23: 68-81.
Acosta Cruz, M; O. Torres y L. Mugica Valdés. 1988. Subnicho trófico de Dendrocygna bicolor (Vieillot) (Aves: Anatidae) en dos áreas arroceras de Cuba. Ciencias Biológicas, 19-20: 41-50.
Aguilera Prieto, E. 1988. La comunidad de ibises (Threskiornitidae) en los llanos de Venezuela. Memoria de la Sociedad de Ciencias Naturales La Salle, 48(130): 59-75.
Amat, J.A. y R.C. Soriguer. 1981. Alimentación primaveral de la Garcita bueyera. Donana Acta Vertebrata, 8: 207-213.
Amat, J.A. 1984. Las poblaciones de aves acuáticas en las lagunas andaluzas. Composición y diversidad durante un ciclo anual. Ardeola, 31:61-79.
Amat, J.A. y E. Aguilera. 1989. Some behavioural responses of Little Egret and Black-tailed Godwit to reduce prey losses from kleptoparasites. Ornis Scandinavica, 20(3): 234-236.
Andrewartha, H.G. y L. C. Birch. 1954. The distribution and abundance of animals. Chicago University Press, Chicago. Aravena, R.O. 1928. Notas sobre la alimentación de las aves. Hornero, 4(2): 153-166.
Armstrong, E.A. 1971. Social signalling and white plumage. Ibis, 113(4): 534.
Ayarzaguena Sanz, J.; J. Pérez Torres y C. Ramo Herrero. 1981. Los garceros del llano. Cuadernos Lagoven, Caracas, 42P.
Basso, N.G. 1990. Estrategias adaptativas en una comunidad subtropical de anuros. Cuadernos de Herpetología, 1: 1-70.
Beltzer, A.H. 1981. Nota sobre fidelidad y participación trófica de Egretta alba egretta (Gmelin, 1789) y Egretta thula thula (Molina, 1782) en ambientes del río Paraná medio (Ciconiiformes, Ardeidae). Revista de la Asociación de Ciencias Naturales del Litoral, 12: 136-139.
Beltzer, A.H. 1981. Bubulcus ibis ibis (L. 1758) Garcita bueyera. Una nueva cita para la provincia de Entre Ríos (Argentina). Memoria del Museo de Entre Ríos, Serie Nueva, Zoología, 3: 1-3.
Beltzer, A.H. 1983 a . Alimentación de la Garcita azulada (Butorides striatus) en el valle aluvial del río Paraná medio (Ciconiiformes: Ardeidae). Revue d´ Hydrobiologie Tropicale, 16(2): 203-206.
Beltzer, A.H. 1983 b. Fidelidad y participación trófica del Macá grande (Podiceps major) y su relación con el Biguá común (Phalacrocorax olivaceus) en ambientes del río Paraná medio (Aves: Podicipedidae y Phalacrocoracidae). Revista de Historia Natural, 3(2): 17-20.
Beltzer, A.H. 1983 c. Nota sobre fidelidad y participación trófica del Biguá común Phalacrocorax olivaceus en ambientes del río Paraná medio (Pelecaniformes: Phalacrocoracidae). Revista de la Asociación de Ciencias Naturales del Litoral, 14(2): 47-52.
Beltzer, A.H. 1983 d. Alimentación del Benteveo (Pitangus sulphuratus) en el valle aluvial del río Paraná medio (Passeriformes: Tyrannidae). Revista de la Asociación de Ciencias Naturales del Litoral, 14(2): 47-52.
Beltzer, A.H. 1984 a . Fidelidad y participación trófica de Agelaius cyanopus (Aves: Icteridae) en ambientes del río Paraná medio. Bolletino di Zoologia, 8: 133-136.
Beltzer, A.H. 1984 b. Alimentación de Phaetusa simplex (Gmelin, 1789) (Aves: Sternidae) en el valle aluvial del río Paraná medio, Argentina. Iheringia, Serie Zoologia, 64: 47-52.
Beltzer, A.H. 1985. Ecología alimentaria de Aramides ypecaha (Aves: Rallidae) en el valle aluvial del río Paraná medio (Argentina). Revista de la Asociación de Ciencias Naturales del Litoral, 16(1): 73-83.
Beltzer, A.H. 1989. Fluctuaciones anuales en las poblaciones de garzas (Aves: Ardeidae) en la llanura aluvial del río Paraná medio, Argentina. Revista de la Asociación de Ciencias Naturales del Litoral, 20(1-2): 111-114.
Beltzer, A.H. 1990 a . Biología alimentaria del Gavilán común Buteo magnirostris (Aves: Accipitridae) en el valle aluvial del río Paraná medio, Argentina. Ornitología Neotropical, 1(1): 1-7.
Beltzer, A.H. 1990 b. Biología alimentaria del Verdón común Embernagra platensis (Aves: Emberizidae) en el valle aluvial del río Paraná medio, Argentina. Ornitología Neotropical, 1(1): 25-30.
Beltzer, A.H. 1991. Aspects of the foraging ecology of the waders Tringa flavipes, Calidris fuscicollis and Charadrius collaris (Aves: Scolopacidae and Charadriidae) in Del Cristal Pond (Santa Fe , Argentina). Studies on Neotropical Fauna and Environment, 26(2): 65-73.
Beltzer, A.H. 1991. Aspects of the breeding biology and the death rate of the Butorides striatus (Aves: Ardeidae). Revista de la Asociación de Ciencias Naturales del Litoral, 22(1): 35-40.
Beltzer, A.H. y O.B. Oliveros. 1981. Alimentación de aves en el valle aluvial del río Paraná medio. II. Egretta alba egretta (Gmelin, 1789) y Egretta thula thula (Molina, 1782) (Ciconiiformes: Ardeidae). Ecología, 6: 119-124.
Beltzer, A.H. y O.B. Oliveros. 1982. Alimentación del Macá grande (Podiceps major) en el valle aluvial del río Paraná medio (Podicipediformes: Podicipedidae). Revista de la Asociación de Ciencias Naturales del Litoral, 13: 5-10.
Beltzer, A.H. 1986. Estudio preliminar de la avifauna de la laguna Del Cristal (Cuenca del río Saladillo, Santa Fe, Argentina). Historia Natural, 6(8): 65-74.
Beltzer, A.H. y O.B. Oliveros. 1987. Alimentación de los Martín pescadores (Ceryle torquata, Chloroceryle amazona y Chloroceryle americana) en la llanura aluvial del río Paraná medio (Coraciiformes: Alcedinidae). Ecología Argentina, 8: 1-10
Beltzer, A.H. y O.B. Oliveros. Alimentación de la Garza bruja Nycticorax nycticorax (Aves: Ardeidae) en el valle aluvial del río Paraná medio. (Inéd.)
Beltzer, A.H. y J.J. Neiff. 1992. Distribución de las aves en el valle del río Paraná. Relación con el régimen pulsátil y la vegetación. Ambiente Subtropical, 2: 77-102.
Begon, M.; J.L. Harper y C.R. Towsend. 1988. Ecología. Individuos, Poblaciones y Comunidades. Omega, Barcelona, 866 p.
Bell, S.S.; E.D. Mc Coy y H.R. Mushinsky. 1991. Habitat structure. The physical arrangement of objects in space. Chapman and Hall, London, 438 p.
Bignal, E.M.; D.J. Curtis y J.L. Matthews. 1988. Islau Land Types. Birds habitats and nature conservation. Part. 1: Land use and birds on Islay. NCC Chief Scientist Directorate, 809, Part. 1.
Blondel, J. 1986. Biogeografía y ecología. Academia, Leon, 190 p.
Bo, N. y C. Darrieu. 1993. En: Ageitos de Castellanos Ed. Fauna de agua dulce de la República Argentina. Aves: Ciconiiformes, Vol. 43, Fasc. 18, FECIC, Buenos Aires, 59 p.
Bogliani, G. 1980. Nitticore che catturano pesci tuffandosi. Avocetta, 4: 87-89.
Bozinovic, F. 1993. Fisiología ecológica de la alimentación y digestión en vertebrados: modelos y teorías. Revista Chilena de Historia Natural, 66: 375-382.
Bozinovic, F. y J.F. Merrit. 1991. Conducta, estructura y función en micromamíferos en ambientes estacionales: mecanismos compensatorios. Revista Chilena de Historia Natural, 64: 19-28.
Bowman, R.L. 1961. Morphological differentiation and adaptation in the Galapagos finches. University of California Publications in Zoology, 58.
Brillouin, I. 1965. Science and Information theory. Academic Press, New York, 346 p.
Cabrera, A. 1932. La incompatibilidad ecológica. Una ley biológica interesante. Anales de la Sociedad Científica Argentina, 114: 243-260.
Cody, M.L. 1968. On the methods of resource division in Grassland bird community. American Naturalist, 102: 107-147.
Cody, M.L. 1974. Competition and the structure bird communities. Princeton University Press, Princeton, 318 p.
Cole, G.A. 1988. Manual de Limnología. Hemisferio Sur, Buenos Aires, 405 p.
Colinvaux, P.A. 1980. Introducción a la ecología. Limusa, México, 679 p.
Colwel, R.K. y D.J. Futuyma. 1971. On the measurement of niche breath and overlap. Ecology, 52: 567-576.
Connel, J.H. 1983. On the prevalence and relative importance of interspecific competition, evidence from field experiments. American Naturalist, 122: 661-696.
Cordiviola de Yuan. 1980. Campaña limnológica Keratella I en el río Paraná medio. Taxocenos de peces de ambientes leníticos. Ecología, 4: 103-113.
De la Peña , M.R. 1976. Aves de la provincia de Santa Fe. Castellví, Santa Fe, 25 p.
Duncan, P. 1983. Determination of the use of habitat by horses in Mediterranean wetland. Journal of Animal Ecology, 52: 93-109.
Dobzhansky, T.; F. Ayala; G.L. Stebbins y J.W. Valentine. 1983. Evolución. Omega, Barcelona, 558 p.
Eckhardt, R.CV. 1979. The adaptive syndromes of two guilds of insectivorous birds in the Colorado Rocky Mountains. Ecological Monographs, 49: 129-149.
Elton, C. y R.S. Miller. 1954. The ecological survey of animal communities: with a practical system of classifying habitats by structural cahracters. Journal of Ecology, 42: 460-496.
Erwin, R.M.; J.S. Hatfield y W.A. Link. 1991. Social foraging and feeding environment of the Black-crowned Night Heron in an industrialised estuary. Bird Behaviour, 9: 94-102.
Ewins, P.J. y B. Hennessey. 1993. Great Blue Herons, Ardea herodias, feeding at a fishing vessel offshore in Lake Erie. Canadian Field Naturalist, 106: 521-522.
Fasola,, M.; P. Galeotti; G. Bogliani y P. Nardi. 1981. Food of Night Heron (Nycticorax nycticorax) and Lettle Egret (Egretta garzetta) feeding in rice fields. Revista Italiana di Ornitología, 51(1-2): 97-112
Fasola, M.; P. Rosa y L. Canova. 1993. The diet of Squacco Herons, Little Egrets, Night Purple and Grey Herons in their Italian breeding ranges. Revue d´Ecologie. la Terre et la Vie, 48: 35-47.
Foley, W.J. y S.J. Cork. 1992. Use of fibrons diets by small herbivores: how far can the rules be “bent”? Trends in Ecology and Evolution, 7: 159-162.
Frederick, P.C. y M.W. Collopy. 1989. Nesting success of 5 Ciconiiform species in relation to water conditions in the Florida Everglades. Auk, 106: 625-634.
Frederick, P.C.; N. D. Wyer; S. Fitzgerald y R.E. Bennets. 1990. Relative abundance and habitat preferences of Least Bitterns (Ixobrychus exilis) in the Everglades. Florida Field Naturalist, 18(1): 1-9
Forbes, L.S. 1987. Feeding behaviour of Great Blue Herons at Creston, British Columbia. Canadian Journal of Zoology, 65: 3062-3067.
Gibbs, J.P. 1991. Spatial relationships between nesting colonies and foraging areas of Great Blue Herons. Auk, 108: 764-770.
Giller, P.S. 1984. Community structure and the niche. Chapman & Hall, London, 176 p.
Giraudo, A.R. y A.H. Beltzer. 1992. Avifauna de un ambiente lenítico del río Paraná y consideraciones sobre la influencia del ciclo hidrológico en su variación estacional. Resumenes II Congreso Brasilero de Ornitologia, Brasil, p. 81.
Hancock, J. & H. Elliot. 1978. The herons of the world. Harper & Row, New York, 304 p.
Hanzak, J. 1968. Gran enciclopedia ilustrada de las aves. Lectura, Caracas, 582 p.
Hassel, M.P. 1988. Dinámica de la competencia y la depredación. Oikos-Tau, Barcelona, 102 p.
Heimsanth, S.F.; J. Lopez de Casenave; V.R. Cueto y E. A. Cittadino. 1933. Uso del hábitat en Fulica armillata, Fulica leucopetra y Gallinula chloropus durante la primavera. Hornero, 13(4) 286-289.
Hoar, W.S. 1978. Fisiología general y comparada. Omega, Barcelona, 855 p.
Hudson, G.E. 1974. Aves del Plata. Libros de Hispanoamérica, Buenos Aires, 361 p.
Hurtubia, J. 1978. Trophic diversity measurements in sympatric predatory species. Ecology, 54: 885-890.
Hutchinson, G.E. 1967. A treatise on Limnology. vol.II, John Wiley, New York, 1115 p.
Hutchinson, G.E. 1979. El teatro ecológico y el drama evolutivo. Blume, Barcelona, 151 p.
Hutchinson, G.E. 1981. Introducción a la ecología de poblaciones. Blume, Barcelona, 492 p.
Iriondo, M. y E.C. Drago. 1972. Descripción cuantitativa de dos unidades geomorfológicas de la llanura aluvial del Paraná medio, República Argentina. Revista de la Asociación Geológica Argentina, 27(2): 143-154.
Jaksic, F.; H. Greene y J. Yanez. 1981. The guild structure of a community of predatory vertebrates in Central Chile. Oecologia, 49: 21-28.
Jenni, D.A. 1969. A study of the ecology of four species of herons during the breeding season at lake Alice, Alachna Country Florida. Ecological Monographs, 39: 245-270.
Jenni, D.A. 1973. Regional variation in the food of Nestling Cattle Egrets. Auk, 90(4): 821-826.
Johansen, K. 1966. Air breathing in the teleost Symbranchus marmoratus . Comparative Biochemistry and Physiology, 18: 383-395.
Jorde, D.G. y R.B. Owen. 1988. The need for nocturnal activity and energy budget of waterfowl. In: waterfowl in winter. Ed. M.W. Weller. University of Minnesota Press, p: 169-180.
Jordano, P. 1981. Alimentación y relaciones tróficas entre los paseriformes en paso otoñal por una localidad de Andalucía central. Donana Acta Vertebrata, 8: 103-124.
Kahl, M.P. 1964. Food ecology of the Woods Stork (Mycteria americana) in Florida. Ecological Monographs, 34: 97-117.
Kersten, B.M.; R.H. Britton; P.S. Dugan y H. Hafner. 1991. Flock feeding and food intake in Little Egrets: the effectsof prey distribution and behaviour. Journal of Animal Ecology, 60: 241-252.
Krebs, J.R. 1974. Colonial nesting and social feeding strategies for exploiting food resources in the Great Blue Heron (Ardea herodias). Behaviour, 51: 94-134.
Krebs, J.R. 1978. Optimal foraging: decision rules for predators. Behavioural Ecology, 23: 23-63.
Krebs, C.J. 1986. Ecología. Análisis experimental de la distribución y abundancia. Pirámide, Madrid, 782 p.
Kufner, M.B.; A. Pelliza Sbriller y S. Monge. 1992. Relaciones tróficas de una comunidad de herbívoros del desierto del monte (Argentina) durante la sequía invernal. Iheringia, Serie Zoolgía, 72: 113-119.
Kushlan, J.A. 1976-a. Wading bird predation in seasonally fluctuating pond. Auk, 93: 464-476.
Kushlan, J.A. 1976-b. Feeding behaviour of north American Herons. Auk, 93(1): 86-94.
Kushlan, J.A. 1978. Non rigorous foraging by Robbing Egrets. Ecology, 59(4): 649-653.
Kushlan, J. 1981. Resource use strategies of wading birds. Wilson Bulletin , 93(2): 145-163.
Lack, D.L. 1945. Ecology of Closely related species with special reference to cormorant (Phalacrocorax carbo and Phalacrocorax aristotelis). Journal of Animal Ecology, 14: 12-16.
Lack, D. 1971. Ecological isolation in birds. Harvard Univ. Press, Cambridge.
Levins, R. 1968. Evolution in changing environments. Princeton Univ. Press, New Jersey, 120 p.
Lopez-Ornat, A. y C. Ramo. 1992. Colonial waterbirds population in the Sian Ka'an Biosphere Reserve (Quintana Roo, Mexico). Wilson Bulletin, 104(3): 501-515.
Marion, L. 1989. Territorial feeding and colonial breeding are not mutually exclusive: The case of the grey heron (Ardea cinerea). Journal of Animal Ecology, 58: 693-710.
Margalef, R. 1977. Ecología. Omega, Barcelona, 951 p.
Margalef, R. 1983. Limnología. Omega, Barcelona, 1010 p.
Marion, L. 1989. Territorial feeding and colonial breeding are not mutually exclusive: the case of the Grey Heron (Ardea herodias). Journal of Animal Ecology, 58: 693-710.
Marquis, M. y A.F. Leitch. 1990. The diet of Grey Heron Ardea cinerea breeding at Loch Leven, Scotland and the importance of their predation on ducklings. Ibis, 132: 335-549.
Master, T.L.; M. Frankel y M. Russel. 1993. Benefits of foraging in Mixed-species wader agregations in a Southern New Jersey Saltmarch. Colonial Waterbird, 16(2): 149-157.
Maule, A.G. y H.F. Horton. 1984. Feeding ecology of walleye, Sttizostedion vitreun vitreun in the midColumbia river, with emphasis on the interaction between valleye and juvenile anadromous fishes. Fisheries Bulletin, 82: 411-418.
Mc Arthur, R.H. 1957. On the relative abundance of birds species. Proceeding of the Natural Academy of Science, 43: 293- 295.
Mc Arthur, R.H. 1958. Population ecology of some warblers of notrheastern coniferous forest. Ecology, 39: 599- 619.
Mc Arthur, R.H. 1972. Geographical ecology. Harper & Row, New York, p
Mc Neil, K.; R. Benoit y J.L. Desgranges. 1993-a. Daytime and nightime activity at a breeding colony of Great Blue Herons in a nontidal environment. Canadian Journal of Zoology, 71: 1075-1078.
Madsen, J. y C. Mortensen. 1987. Habitat exploitation and interspecific competition of moulting geese in east Greenland. Ibis, 129: 25-44.
Mc Arthur, R.H. 1972. Geographical ecology. Harper & Row, New York, p
Mc Naughton, S.J. y L.L. Wolf. 1984. Ecología general. Omega, Barcelona, 713 p.
Mc Neil, R.; P. Drapeau y R. Pierotti. 1993. Nocturnally in colonial waterbirds: occurrence, special adaptations and suspected benefits. Current Ornithology, 10: 187-246.
Mc Neil, R.; P. Drapeau y J.D. Goss-Custard. 1992. The occurrence adaptive significance of nocturnal habits in waterfowl. Biological Reviews, 67: 381-419.
Martínez, M.M. 1993. Las aves y la limnología. Conferencias de Limnología, La Plata, ILPLA, 127-140
Miller, R.S. 1967. Pattern and process in competition. Advances in Ecological Research, 4: 1-74.
Mogilner, J. y R. Arámburu. 1969. Relaciones alimentarias de las aves acuáticas en la laguna de Chascomús. Conv. Estud. Riqueza Ictíc ., 4ta. etapa, La Plata, 4.
Mora, M.A. 1992. Habitat use by foraging Cattle Egrets in the Mexican Valley, Baja California. Wilson Bulletin, 104(1):142-148.
Morales, G. 1992. Las aves acuáticas del alto Apure. Universidad Central de Venezuela, Caracas, 56 p.
Mosso, E.D. y A.H. Beltzer. 1992. Nuevos aportes a la biología reproductiva de la Garcita azulada Butorides striatus (Aves: Ardeidae). Hornero, 13(3): 236-237.
Neiff, J.J. 1975. Fluctuaciones anuales en la composición fitocenótica y biomasa de la hidrofitia en lagunas isleñas del Paraná medio. Ecosur, 2(4): 153-183.
Neiff, J.J. 1979. Fluctuaciones de la vegetación acuática en ambientes del valle de inundación del Paraná medio. Physis, Sec. B., 38(95): 41-53.
Neiff, J.J. 1986 a . Las grandes unidades de vegetación y los ambientes insulares del río Paraná en su tramo Candelaria-Ita Ibate. Revista de la Asociación de Ciencias Naturales del Litoral, 17(1): 7-30.
Neiff, J.J. 1986 b. Aspectos metodológicos y conceptuales para el conocimiento de las áreas anegables del Chaco Oriental. Ambiente Subtropical, 1: 1-4.
Neiff, J.J. y J.A. Orellana. 1972. Diferenciación de ambientes en una cuenca isleña del Paraná medio sobre la base de las unidades de vegetación y suelos asociados. Revista de la Asociación de Ciencias Naturales del Litoral, 3: 3-17.
Nores, M. y D. Yzurieta. 1980. Aves de ambientes acuáticos de Córdoba y Centro de Argentina. Secretaria de Agricultura y Ganadería , Córodba, 236 p.
O'Connor, T.G. 1993. The diet of nestling Cattle Egrets in the Transvaal. Ostrich, 64: 44-45.
Olivares, A. 1973. Las Ciconiiformes Colombianas. Proyser, Bogotá, 303 p.
Pianka, E.R. 1973. The structure of lizards communities. American Review of Ecology and Systematics, 4: 53-74.
Pianka, E.R. 1975. Niche relationships of desert lizards. En: M.L. Cody y J.M. Diamons(eds.), Ecology and Evolution of communities. Harvard University Press: 292-314.
Pianka, E.R. 1982. Ecología evolutiva. Omega, Barcelona, 365 p.
Pinkas, L.; M.S. Oliphant y Z.I. Iverson. 1971. Food and feeding habits of Albacore bluefin tuna and bonito y the California waters. Department of Fish and Game, Fisheries Bulletin, 150: 1-105.
Poysa, H. 1983. Resource utilization pattern and guild structure in a waterfowl community. Oikos, 40: 295-307.
Powel, G.U.N. 1982. Habitat use by wading birds in a subtropical estuary: implications of hydrogeography. Auk, 104: 740-749.
Remmert, H. 1988. Ecología. Autoecología, ecología de poblaciones y estudios de ecosistemas. Blume, Barcelona,304 p.
Robert, M.; R. McNeil y A. Leduc. 1989. Conditions and significance of night feeding in shorebirds and other water birds in a Tropical lagoon. Auk, 106: 94-101.
Robinson, W.L. y D.J. Groebner. 1991. Foraging of Gray Woloves at a Great Blue Heron Rookery. American Midland Naturalist, 126: 196-197.
Rohwer, S. 1988. Foraging differences between White and Dark morphs of the Pacific Reef Heron Egretta sacra. Ibis, 132: 21-26.
Roughgarden, J. 1983. Competition and theory in community ecology. American Naturalist, 122: 583-601.
Root, R.B. 1967. The niche explotation pattern of the Bluegray Gnat Catcher. Ecological Monographs, 37: 317-350.
Saver, F. 1984. Aves acuáticas. Blume, Barcelona, 286 p.
Shealer, D.A. y S.W. Kress. 1991. Nocturnal abandonment response to Black-Crowned Night Heron Disturbance in a Common Tern colony. Colonial Waterbirds, 14(1):51-56.
Schefler, W.C. 1979. Bioestadística. Fondo Educativo Interamericano, Mexico, 267 p.
Schmidt-Nielsen, K. 1983. Fisiología animal. Adaptación y medio ambiente. Omega, Barcelona, 499 p.
Schoener, T.W. 1974. Resource partitioning in ecological communities. Science, 185: 27-39.
Schoener, T.W. 1983. Field experiments on interspecific competition. American Naturalist, 122: 240-285.
Scortecci, G. 1969. Los animales. Aves. Vol.3. Vergara, Barcelona, 642 p.
Siegfried, W. 1976. Segregation in feeding behaviour of four diving ducks in Southern Manitoba. Canadian Journal of Zoology, 54: 730-736.
Smith, W.J. 1982. Etología de la comunicación. Fondo de Cultura Economica, México, 609 p.
Sokal, R.R. y F.J. Rohlf. 1969. Biometría. Principios y métodos estadísticos en la investigación biológica. Blume, Madrid, 832 p.
Southwood, J. 2003. El Proceso Coevolutivo. Fondo de Cultura Económica, México, 289p.
Stott, R. y D. Olsoon. 1973. Food habitat relationship of sea duck on the New Hampshire coastline. Ecology, 54: 996- 1007.
Tosi, G. y S. Toso. 1979. Night Herons Nycticorax nycticorax wintering in the Po River Valley. Ibis, 121: 336
Trexler, J.C.; P.C. Tempe y J. Travis. 1994. Size-selective predation of Sailfin mollies by two species of herons. Oikos, 69: 250-258.
Vides Almonacid, R. 1987. Organización temporal de las comunidades de aves del bosque de aliso en las cumbres de Tafí, Tucumán. Res. VI Reunión Argentina de Ornitología, Tucumán, p. 49.
Watmough, B.R. 1978. Observation on nocturnal feeding by Night Heron Nyctivorax nycticorax . Ibis, 120: 356-358.
Weller, M. 1976. Waterfowls in wetlands NE Argentine. Ibis, 109: 391-411.
Ward, P. 1965. Feeding ecology of the Black-faced Quelea quelea in Nigeria. Ibis, 107: 173-214.
Wetzel, R.G. 1981. Limnología. Omega, Barcelona, 679 p.
White, D. y D. James. 1978. Differential use of fresh water environments by wintering waterfowl of coastal Texas. Wilson Bulletin, 90: 99-111.
Whitfield, A.K. y D.P. Cyrus. 1978. Feeding succesion and zonation of aquatic birds at Falbe Bay Lake, St. Lucia. Ostrich, 49: 8-15.
Wiens, J.A. y J. Rotenberry. 1979. Diet niche relation ships among North american grassland and shrubteppe birds.Oecologia, 42: 253-292.
Wiggins, D.A. 1991. Foraging succes and agregation in solitary and group-feeding Great Egrets (Casmerodius albus). Colonial Waterbirds, 14(2): 176-179.
Wilson, E.O. Sociobiología. La nueva síntesis. Omega, Barcelona, 701 p.
Wolf, B.O. y S.L. Jones. 1989. Great Blue Heron death caused by predation on Pacific Lamprey. Condor, 91: 482-484.
Ziswiler, V. 1980. Zoología especial Vertebrados. T.2, Omega, Barcelona, 413 p.
Zotta, A. 1934. Sobre el contenido estomacal de aves argentinas. Hornero, 4(3): 376-383.