La avifauna de la selva de galería en el noreste de Corrientes, Argentina: Biodiversidad, Patrones de Distribución y Migración
Patricia CAPLLONCH 1 ; Rebeca LOBO; Diego ORTIZ y Ramiro OVEJERO
1 Centro Nacional de Anillado de Aves, Facultad de Ciencias Naturales e Instituto Miguel Lillo, UNT. Miguel Lillo 205 (4000) Tucumán, Argentina. E-mail: cenaarg@yahoo.com.ar
Abstract: BIRDS OF THE GALLERY FORESTS OF NORTHEASTERN CORRIENTES, ARGENTINA: BIODIVERSITY, DISTRIBUTIONAL PATTERNS AND MIGRATION. We carried out a study of bird species richness, in the western side of the Uruguay River, Corrientes Province. We registered 185 species of birds, of 44 families. Psilorhamphus guttatus, Pyrrhocoma ruficeps, Amaurospiza moesta and Aimophila strigiceps are mentioned for the first time for the province. The great environmental heterogeneity where the Chacoan, Pampeana, and Paranaense regions converge it is reflected in the avifauna, and the Uruguay River serves as a biological corridor among these regions. Migratory displacements were observed in a third of the registered avifauna.
Key words: gallery forest - Uruguay river - birds fauna - biodiversity - migration.
Palabras clave: Selva en galería - Río Uruguay - Corrientes - Avifauna - Diversidad - Migración.
Introducción
La provincia de Corrientes ha sido objeto de diversos viajes de colecta por parte de Partridge, quien reunió una importante colección ornitológica entre 1959 y 1962, publicando parcialmente estos datos antes de su fallecimiento (1962, 1963, 1964). Contreras (1981, 1986a, 1986b, 1987); Contreras y Contreras (1984) Darrieu (1986, 1987); Darrieu y Camperi (1988, 1990, 1991, 1993, 1994, 1996); Darrieu y Martínez (1984); Fraga (2001); Gómez et al. (1992); García Fernández et al. (1996); Short (1971, 1975), hicieron luego aportes que contribuyeron en buena medida al conocimiento de su avifauna. Recientemente, Giraudo et al. (2003) realizaron un extenso relevamiento y revisión bibliográfica de la avifauna del Iberá que se encuentra próximo, donde registraron 344 especies de aves y que utilizamos para comparar con los resultados obtenidos durante este estudio.
La Provincia Biogeográfica Paranaense o Selva Atlántica interior se encuentra en Argentina en Misiones y noreste de Corrientes. Está considerada una de las áreas con mayor diversidad y más amenazadas del mundo debido a que a desaparecido cerca de un 95% de sus selvas y bosques originales, del sudeste de Brasil, este de Paraguay y nordeste de Argentina (Giraudo y Povedano, 2004). Por su endemicidad, elevada biodiversidad y alto grado de amenaza es considerada un "hot spot" de interés mundial (Myers et al., 2000)
Este trabajo presenta los resultados preliminares de estudios sobre la avifauna del Río Uruguay y sus selvas ribereñas en el litoral argentino. El objetivo es registrar la diversidad y las migraciones de aves en distintos puntos a lo largo del río, en las provincias de Corrientes, Entre Ríos y Buenos Aires.
Área de Estudio
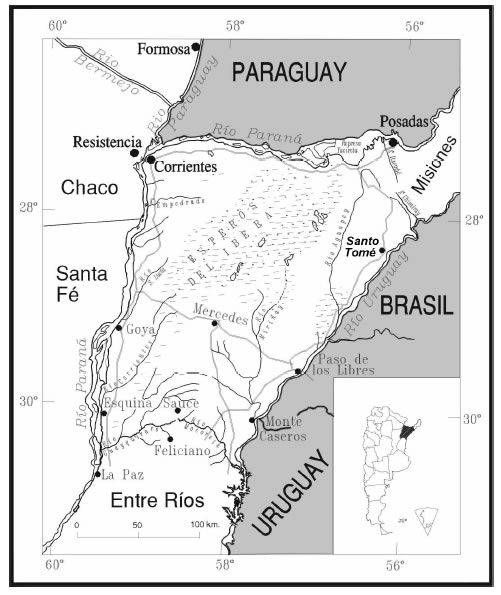
El área de estudio esta ubicada frente a la Isla de San Mateo, en la ribera oeste del Río Uruguay (28º29' S 55º57' W), 17 Km al norte de Santo Tomé, provincia de Corrientes (Figura 1).
El muestreo se realizó entre el 14 y el 20 de Septiembre del 2003 y el 14 y 21 de Abril del 2004 en la Estancia La Blanca. Las parcelas estaban ubicadas en una selva de galería con tacuarales al borde del río Uruguay, y en un ambiente lindante con lomadas suaves con pastizales húmedos y arbustales con mogotes aislados. Fitogeográficamente la zona corresponde al Distrito de los Campos (Cabrera,1976), caracterizado por campos o sabanas de gramíneas de Elionurus sp., Aristida jubata, Paspalum urdillei, Paspalum notatum, Panicum sp., Eragrostis sp y Axonopus sp, la selva sólo aparece en las orillas del río Uruguay, en forma de galería (Figura 2), o bien naturalmente formando pequeñas manchas, capones o mogotes en lugares donde se acumula humedad en el suelo. En los terrenos inundados hayEupatorium sp. y Eryngium sp. En los lugares muy húmedos todo el suelo esta cubierto con musgos del Género Sphagnum. La vegetación de la selva en galería sobre el río Uruguay, está compuesta por extensos tacuarales (Guadua sp., Chusquea sp y Merostachys sp), palmeras Pindó (Syagrus romanzoffianus), Palmito (Euterpes edulis), Lapacho rosado (Tabebuia impetiginosa), Pacará (Enterolobium contortisiliquum), Guatambú blanco (Balfourodendron riedelianum), Laurel negro (Nectandra saligna), Laurel del río (Nectandra falcifolia), Chalchal (Allophyllus edulis), Ibapoy o higueròn (Ficus monckii) y Fumo bravo (Solanum granuloso leprosum) entre otros.
Los remanentes de selva en galería, limitan con pastizales que contienen mogotes con Selva Paranaense empobrecida (Figura 3). En los terrenos bajos hay pantanos y aguadas con densos juncales y vegetación palustre.

Fig. 1. Mapa general de ubicación de Santo Tomé.

Fig. 2. Selva en galería de la ribera oeste del río Uruguay, provincia de Corrientes, con la isla de San Mateo al centro y la costa brasilera enfrente. (Foto Patricia Capllonch).

Fig. 3. Mogote de Selva Paranaense rodeado de pajonales en la estancia La Blanca, Santo Tomé, provincia de Corrientes. Al fondo el río Uruguay y la selva en galería. (Foto Patricia Capllonch)
Materiales y Métodos
Se utilizaron 12 redes de neblina de 12 metros de largo que operaron día y noche, durante 14 días. Las aves capturadas fueron marcadas con anillos del CENAA (Instituto Miguel Lillo, UNT), medidas y pesadas. Se realizaron observaciones de plumajes y muda para correlacionarlos con los desplazamientos migratorios, condición reproductiva, medidas corporales y peso. Se llevó un registro fotográfico de las especies mediante cámara digital.
Se realizaron además censos de recorrida por sendas existentes y bordes del río. Por último, se identificaron algunas especies mediante los cantos, realizándose grabaciones que se analizaron comparando registros de cantos y voces de aves.
Resultados
Se observaron patrones de abundancia, distribución y migración de aves, que merecen comentarios. La diversidad local es muy alta. Fueron registradas 186 especies de aves (Apéndice 1) en 14 días de muestreo. Se registraron 59 especies exclusivas de selvas, 30 de ambientes abiertos y bordes de selvas, y 45 de ambientes acuáticos. Las 52 especies restantes tienen amplia distribución en una variedad de ambientes en Argentina. Todos estos ambientes, selva, pastizal y juncal, estaban lindantes dentro de un área de aproximadamente 1000 Ha.
1. Rhea americana |
94. Phacellodomus ruber 95. Hypoedaleus guttatus 96. Dysithamnus mentalis 97. Conopophaga lineata 98. Psilorhamphus guttatus 99. Chiroxiphia caudata 100. Xolmis dominicana 101. Xolmis cinerea 102. Knipolegus cyanirostris 103. Gubernetex yetapa 104. Machetornis rixosus 105. Pitangus sulfuratus 106. Megarhynchus pitangua 107. Tyrannus savana 108. Tyrannus melancholicus 109. Myiarchus tyrannulus 110. Empidonax euleri 111. Tolmomyias sulphurescens 112. Platyrinchus mystaceus 113. Todirostrum plumbeiceps 114. Phylloscartes ventralis 115. Phylloscartes eximius 116. Culicivora caudacuta 117. Pyrocephalus rubinus 118. Serpophaga subcristata 119. Serpophaga nigricans 120. Elaenia flavogaster 121. Elaenia chiriquensis 122. Elaenia mesoleuca 123. Leptopogon amaurocephalus 124. Myiornis auricularis ? 125. Progne chalybea 126. Phaeoprogne tapera 127. Tachycineta leucorrhoa 128. Stelgidopteryx ruficollis 129. Cyanocorax chrysops 130. Donacobius atricapillus 131. Cistothorus platensis 132. Troglodytes aedon 133. Anthus natterei 134. Anthus correndera 135. Anthus hellmayri 136. Mimus saturninus 137. Turdus amaurochalinus 138. Turdus rufiventris 139. Turdus leucomelas 140. Turdus albicollis 141. Polioptila dumicola 142. Basileuterus culicivorus 143. Basileuterus leucoblepharus 144. Parula pitiayumí 145. Geothlypis aequinoctialis 146. Euphonia chlorotica 147. Trichothraupis melanops 148. Tachyphonus coronatus 149. Tachyphonus rufus 150. Thraupis sayaca 151. Pipraeidea melanonota 152. Piranga flava 153. Pyrrhocoma ruficeps 154. Thlypopsis sordida 155. Saltator similis 156. Paroaria coronata 157. Paroaria capitata 158. Cyanocompsa brissonii 159. Cyanoloxia glaucocaerulea 160. Amaurospiza moesta 161. Volatinia jacarina 162. Sporophila caerulescens 163. Sporophila collaris 164. Sicalis luteola 165. Sicalis flaveola 166. Coryphospingus cucullatus 167. Zonotrichia capensis 168. Aimophila strigiseps 169. Ammodramus humeralis 170. Emberizoides ypiranganus 171. Emberizoides herbicola 172. Carduelis magellanica 173. Cacicus chrysopterus 174. Cacicus haemorrhous 175. Cacicus solitarius 176. Gnorimopsar chopi 177. Icterus cayanensis 178. Molothrus rufoaxilaris 179. Molothrus bonariensis 180. Molothrus badius 181. Agelaius ruficapillus 182. Agelaius cyanopus 183. Agelaius thilius 184. Xanthopsar flavus ? 185. Pseudoleistes guirahuro 186. Pseudoleistes virescens |
Apéndice 1. Especies del Distrito de los Campos de Santo Tomé, Corrientes.?. Especies que necesitan confirmación
Selva en galería: Las especies exclusivamente de selvas fueron registradas solamente dentro de ese hábitat y varias eran tan crípticas que se obtuvieron por el uso de las redes o grabaciones de cantos. Comparando con la lista de Giraudo et al. (2003) para Esteros del Iberá, registramos 24 especies típicamente selváticas no citadas por estos autores. Tres especies obtenidas en la selva de galería son citadas por primera vez para Corrientes: Psilorhamphus guttatus, Pyrrhocoma ruficeps (Figura 4A), y Amaurospiza moesta (Figura 4B). Se capturaron varias lechuzas Otus choliba (Figura 5A). Una de ellas, muy roja y de orejas prominentes, el Alicucú grande (Otus atricapillus), (Figura 5B) cuyos cantos se escucharon en Septiembre, parecidos a los de Otus hoyi de la selva tucumana. El Alicucú grande habita selvas de Misiones (Parque Nacional Iguazú), y hay datos también de su presencia en el extremo norte de Corrientes (Canevari et al. 1991). El gallito overo (Psilorhamphus guttatus), especie conocida en Argentina solo de selvas de Misiones, fue observado en pareja por largo rato en el suelo entre las tacuaras pero por la oscuridad y distancia no pudo ser fotografiado y tampoco capturado. El Pioró (Pyrrhocoma ruficeps), es típico de la Selva Atlántica del sureste de Brasil, donde no es un ave común (Ridgely y Tudor, 1989). En Argentina se lo conoce solamente de Misiones. Un caso similar de distribución es el de la Reinamora enana (Amaurospiza moesta) que estaba citada solo para Misiones y que capturamos en el estrato bajo del denso tacuaral.
Según los datos de captura, las aves más abundantes en Septiembre dentro de la selva fueron Turdus albicollis y Turdus rufiventris. Se obtuvo una recuperación de T. albicollis en Abril, pero estaba casi ausente en las parcelas, mostrando un comportamiento migratorio luego de criar. Turdus rufiventris, es residente, se mantuvo abundante, mientras que T. leucomelas que no había sido observado ni capturado en los muestreos de primavera, fue capturado en el otoño, por lo que parecen ser más raros en la localidad y migratorios. Basileuterus leucoblepharus fue el más abundante en el muestreo de abril, seguido de B. culicivorus, T. rufiventris y Trichothraupis melanops. Se obtuvieron además recuperaciones de Otus choliba y Geothlypis aequinoctialis anillados el año anterior.

Fig. 4. A. Macho joven de Pioró (Pyrrhocoma ruficeps), B. Hembra de Reinamora enana (Amaurospiza moesta). Especies citadas por primera vez para la avifauna correntina. (Fotos Patricia Capllonch y Rebeca Lobo).
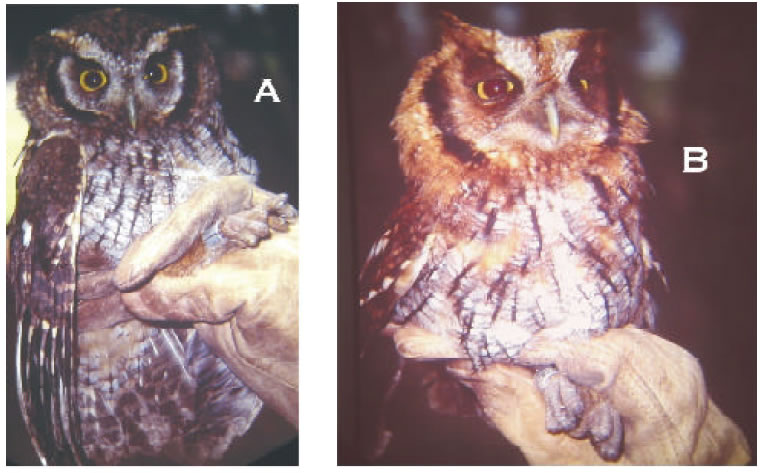
Fig. 5. A. Alicucu común (Otus cholita), B. Alicucú grande (Otus atricapillus) capturados en la selva en galería sobre el río Uruguay. (Fotos Patricia Capllonch).
Las aves que estuvieron presentes en los dos viajes dentro de la vegetación tupida de los tacuarales y selva húmeda fueron Penelope obscura, Piaya cayana, Otus choliba, Trogon surrucura (Figura 6A), Colaptes melanochloros, Veniliornis spilogaster, Syndactila rufosuperciliata (Figura 6B), Hypoedaleus guttatus, Dysithamnus mentalis (Figura 6C), Conopophaga lineata (Figura 6D), Chiroxiphia caudata (Figura 6E), Knipolegus cyanirostris (Figura 6F), Tolmomyias sulphurescens, Platyrinchus mystaceus, Todirostrum plumbeiceps, Phylloscartes ventralis, Leptopogon amaurocephalus, Cyanocorax chrysops (Figura 7A), Turdus rufiventris, Turdus albicollis (Figura 7B), Basileuterus leucoblepharus (Figura 7C), B.culicivorus, Trichothraupis melanops (Figura 7D), Tachyphonus rufus (Figura 7E), T. coronatus, Saltator similis , Cyanoloxia glaucocaerulea (Figura 7F), Cyanocompsa brissonii (Figura 7G) Cacicus chrysopterus (Figura 7H) y Cacicus. haemorrhous. Estas 30 especies residentes dentro de la selva de galería pueden ser utilizadas como diagnósticas por su constancia, ya que el resto de las especies muestran una dinámica compleja de desplazamientos, tanto por la cercanía con otras ecoregiones, como por su carácter migratorio. Varias de las especies capturadas migran al Pantanal del Mato Grosso luego de nidificar como Tyrannus melancholicus,Myiarchus tyrannulus, Saltator similis ( Figura 8E), Icterus cayanensis (Figura 8F), Parula pitiayumi, Geothlypis aequinoctialis y Tachycineta leucorrhoa ( Willis y Oniki, 1990). Otras como Empidonax euleri (Figura 8A) lo hacen hasta Colombia y Venezuela (Verea et al., 2000). Elaenia chiriquensis (Figura 8B) migra hasta la Amazonía del Brasil Central ( Marini y Cavalcanti, 1990), y Turdus amaurochalinus (Figura 8C), se desplaza en invierno atravesando centro y noreste de Brasil (Ridgely yTudor, 1989). Sicalis flaveola(Figura 8D) y S. luteola migran hacia sabanas y montes de Formosa y Paraguay.
La tercera parte de las especies de Santo Tomé no estaba presente en ambos censos de primavera y otoño, mostrando una dinámica migratoria que aún permanece en gran parte sin estudiar como la de los ictéridos Cacicus solitarius, Molothrus badius, Agelaius ruficapillus, A. cyanopus, A. thilius y Pseudoleistes virescens, y la de los emberícidos Paroaria capitata, Volatinia jacarina, Sporophila caerulescens y S. collaris, que estaban ausentes en Septiembre y eran comunes en Abril. En el mes de Abril se agregaron también muchas especies de tyránidos como Gubernetex yetapa, Megarrhynchus pitangua, Myarchus tyrannulus, Elaenia chiriquensis, E. mesoleuca y Leptopogon amaurocephalus.
La selva en galería de Santo Tomé contiene un grupo de especies endémicas de la región comprendida entre el sureste de Brasil, extremo este de Paraguay y extremo noreste de Argentina. Algunas típicas solo de selvas como Hypoedaleus guttatus, Conopophaga lineata, Psilorhamphus guttatus, Todirostrum plumbeiceps, Chiroxiphia caudata, Phylloscartes eximius, T. melanops, T. coronatus, Pyrrhocoma ruficeps y Amaurospiza moesta. Otras de selvas y bosques abiertos como B. leucoblepharus, C. glaucocaerulea, C. chrysopterus y C. haemorrous. Es importante considerar que varias de ellas están estrechamente asociadas a los tacuarales como Psilorhamphus guttatus, Platyrinchus mystaceus, P. ruficeps, A. moesta, y que por otro lado son consideradas especies poco frecuentes (Narosky e Yzurieta 2003; Ridgely y Tudor 1989,1994).

Fig. 6. Aves residentes de la selva en galería, A. Surucuá (Trogon surrucura), B. Ticotico (Syndactila rufosuperciliata), C. Choca amarilla (Dysithamnus mentalis), D. Chupadientes (Conopophaga lineada), E. Macho joven de Bailarín azul (Chiroxiphia caudata), F. Viudita pico celeste (Knipolegus cyanirostris). (Fotos Patricia Capllonch).

Fig. 7. Aves típicas de la selva en galería del río Uruguay A. Urraca común (Cyanocorax chrysops) (Foto Diego Ortiz), B. Zorzal collar blanco (Turdus albicollis) (Foto Rebeca Lobo), C. Arañero silbón (Basileuterus leucoblepharus) (Foto Rebeca Lobo), D. Frutero corona amarilla (Thrichothraupis melanops), E. Hembra de frutero negro (Tachifonus rufus), F. Hembra de Reinamora chica (Cyanoloxia glaucocaerulea), G. Macho de Reinamora grande (Cyanocompsa brissoni), H.Boyero ala amarilla (Cacicus crhysopterus) (Fotos Patricia Capllonch).

Fig. 8. Aves migratorias de la selva en galería de Santo Tomé. A. Mosqueta parda (Empidonax euleri). B. Fiofío belicoso (Elaenia chiriquensis). C. chalchalero (Turdus amaurochalinus). D. Jilguero dorado (Sicalis flaveola). E.Pepitero verdoso (Saltator similis). F. Boyerito (Icterus cayanensis). (Fotos Patricia Capllonch)
Humedales con mogotes aislados: Ambos ambientes también se muestrearon ya que por su proximidad interactúan y permiten mantener un gran número de especies, algunas compartidas con el Espinal y otras con la Región Pampeana. Los mogotes, separados unos de otros por varias hectáreas, sufren de aislamiento y están empobrecidos en el número de especies. Están frecuentados por Synallaxis frontalis, T. rufiventris, T. amaurochalinus, B. leucoblepharus, B. culicivorus, T. sayaca, T. coronatus, Z. capensis y Carduelis magellanicus como especies de ocurrencia regular. Estas son aves que se distribuyen en una variedad de ambientes arbustivos y de bosques abiertos y de galería. Otras aves registradas fueron Buteo magnrostris, Penélope obscura, Leptoptila verreauxi, Crotophaga ani, Cyanocorax chrysops, Coryphospingus cucullatus e Icterus cayanensis.
Los pastizales, arbustales y terrenos inundados lindantes contienen una serie de especies de limitada distribución y/o rareza como Xolmis dominicana, Xolmis cinerea, Gubernetes yetapa, Knipolegus cyanirostris, Culicivora caudacuta, Donacobius atricapillus, Anthus hellmayri, Anthus nattereri, Sporophila collaris, Emberizoides herbicola, Emberizoides ypiranganus y Pseudoleistes guirahuro. Estos ambientes de pastizal tienen gran importancia porque es frecuente observar a muchas especies con prioridad de conservación a nivel internacional como Gubernetex yetapa del cual se registró una pareja, o como Emberizoides ypiranganus que es endémico del extremo sureste de Brasil (Río Grande Do Sul), este de Paraguay y noreste de Argentina, y que observamos en áreas de pajonal alto cerca del agua en pequeños grupos. Esta especie, fue citada por primera vez por Olrog (1972) para Argentina, aunque antes ya fue reconocida por Partridge quien no tuvo oportunidad de publicar estos datos. Olrog la menciona como común en el noreste argentino (Santa Fé, Corrientes y Misiones) y en el sureste de Brasil.
Varias especies de rapaces poco frecuentes actualmente se observaron en ambientes que rodean a un extenso pantano que desemboca en el río Uruguay Figura: Spizastur melanoleucus, especie considerada vulnerable (Collar et a.l, 1994) fue observada sobrevolando el río Uruguay y una pareja de Gampsonix swainsoni permaneció durante días en árboles altos en el casco de la estancia. Ambas especies fueron citadas por Contreras (1981) para la avifauna correntina y actualmente son raras. Asturina nítida citada por Narosky e Yzurieta (2003) para el noroeste y el noreste, pero poco frecuente de ver, fue observada en grandes árboles aislados, y Micrastur semitorquatus era común en los bordes de selva.
Las redes colocadas en los campos, en ambientes de pajonal inundable próximo a la selva de galería capturaron Phacellodomus striaticollis (Figura 9C), Certhiaxis cinnamomea (Figura 9B), numerosos Knipolegus cyanirostris, Cyanoloxia glaucocaerulea, Sporophila collaris y Agelaius cyanopus (Figura 9D) , y se observaron grupitos de Donacobius atricapillus y Culicivora cuadacuta. Ammodramus humeralis, fue la especie dominante del pajonal en Abril. Es interesante la cantidad de especies de pícidos observados. Encontramos seis especies, tres de ellas estaban exclusivamente en la selva y sus bordes, Colaptes melanochloros, Verniliornis spilogaster y V. Passerinus; las otras tres Colaptes campestris, C. melanolaimus, y Dryocopus lineatus, fueron observadas en árboles aislados entre los pastizales.
En los pajonales y arbustales que se inundan periódicamente, abundan Cistothorus platensis, Zonotrichia capensis y 3 especies de Anthus. Anthus natereri y A. correndera estuvieron presentes en los dos muestreos, mientras que A. hellmayri solo en Abril. Contienen además abundancia de Rhea americana y Rhynchotus r. rufescens que fue numerosa en ambos muestreos, lo que muestra su recuperación luego de que estuvo muy amenazada por la caza. Esta raza fue distinguida por observación y canto, ya que para Corrientes se encuentra también citada la raza R. r. pallecens (Contreras, 1981).
En el muestreo de septiembre se capturó Aimophila strigiceps que no estaba registrada para la provincia de Corrientes. Es una especie de pastizal que se encuentra en expansión y que ya está en Entre Ríos y Buenos Aires (Narosky e Yzurieta, 2003). Se confirmó también la presencia del espinero Phacellodomus striaticollis del cual se capturaron dos ejemplares (Fig. 9c), ya que estaba citado como probable por Giraudo et al, (2003) para el Iberá.
Los juncales contienen además Crotophaga ani, Guira guira, Certhiaxis cinnamomea, Paroaria capitata, Agelaius cyanopus, Pseudoleistes. guirahuro, Molothrus rufoaxilaris y M. bonariensis.
Los desplazamientos de aves eran evidentes tanto en Septiembre como en Abril. Las migraciones observadas en Septiembre eran de arribo de aves que llegaban a nidificar como Crotophaga ani, Hydropsalis brasiliana (Figura 9E), Pyrocephalus rubinus (Figura 9A), Tyrannus savanna, Progne chalybea, Phaeoprogne tapera, Tachycineta leucorrhoa, Icterus cayanensis, Sporophila caerulecens (Figura 9F), Sporophila collaris y Coryphospingus cucullatus. El paso de migrantes australes de ambientes acuáticos era constante durante el mes de Septiembre, garzas, cigueñas, biguáes, varias especies de patos y caracoleros pasaban al anochecer y durante parte de la noche rumbo al sur. Existen comprobadas migraciones de especies acuáticas en sentido este-oeste entre Argentina y sur de Brasil (Olrog, 1975) que atraviesan Corrientes. Por otro lado, las migraciones en el Litoral Argentino son las más intensas de Argentina, ya que involucran los más grandes humedales del país y los comunican con los del Pantanal del Mato Grosso (Capllonch, 2004).

Fig. 9. Aves de pastizales y arbustales de Santo Tomé. A. Joven de Churrinche (Pyrocephalus rubinus). (Foto Diego Ortiz) B. Curutié colorado (Certhiaxis cinnamomea). (Foto Rubén Barquez). C. Espinero pecho manchado (Phacellodomus striaticollis). D. Varillero negro (Agelaius cyanopus) E. Atajacaminos tijera (Hydropsalis brasiliana). (Fotos Patricia Capllonch). F. Macho de Corbatita (Sporophila caerulescens). (Foto Rubén Barquez).
En Abril, eran abundantes las bandaditas de corbatitas, Sporophila collaris y S. caerulescens formadas por jóvenes y adultos, con procesos de muda en el plumaje, listos para emprender la migración hacia el norte. Esta migración se retrasó por la sequía que afecto esta zona, las lluvias llegaron al final del verano. No se observaron otras especies de Sporophila. También había agrupaciones de Sicalis flaveola y S. luteola., y muchos ictéridos. Se observaron bandaditas de Varrilleros negros (Agelaius cyanopus), Chopíes (Gnorimopsar chopi), Boyeros cacique (Cacicus haemorrous) y Pechos amarillos grandes (Pseudoleistes guirahuro).
Casi todas las especies capturadas presentaban mudas otoñales en el plumaje, como un joven de Pyrocephalus rubinus especie que se desplaza en migración hasta el norte de Sudamérica. Se observaron desplazamientos en grandes bandadas de Siriríes (Dendrocygna sp), Garzas brujas (Nycticorax nycticorax) y chiflones (Syrigma sibilatrix).
Discusión
A pesar de las numerosas listas de aves publicadas sobre Corrientes, el conocimiento de su avifauna es aún escaso. Existen zonas de alta diversidad potencial no muestreadas aún, quizás zonas poco extensas pero que albergan relictos o refugios faunísticos amparados de la creciente destrucción de los ambientes. El trabajo de Giraudo et al. (2003) es el más completo que se ha publicado recientemente sobre la avifauna provincial. Si bien el área muestreada no corresponde a los Esteros del Iberá mismos, éstos están muy próximos, por lo que se ha tomado como referencia este trabajo para la ocurrencia de las especies. Por otro lado, de las tres provincias del litoral fluvial argentino, Misiones, Corrientes y Entre Ríos, solo la primera es bien conocida. En gran parte debido a que elárea del Parque Nacional Iguazú ha sido muy bien estudiada. Pero también porque las dos provincias restantes contienen vastas zonas de difícil acceso, cubiertas por aguas que las inundan estacionalmente o separadas por anchos ríos y arroyos.
La zona que tratamos es límite entre la Selva Atlántica Interior (Cabrera y Willink, 1973) y la regiones Espinal y Pampeana, de allí la composición heterogénea de los taxones de aves y su diversidad. La Selva Atlántica Interior, ecoregión Paranaense en Argentina, es considerada la más diversa y de más alto endemismo de Argentina (Stotz et al., 1996). Por otro lado, el Distrito de los Campos, con 401 especies de aves, es una de las áreas con mayor riqueza de aves de Argentina (Giraudo y Povedano, 2004). Una particularidad de esta selva es la selva de galería que discurre a lo largo de los grandes ríos (Silva, 1996). Es aún pobremente conocida como demuestran estos muestreos, donde aparece un grupo de especies nuevas para la provincia. Este cambio en la composición de la avifauna puede ser explicado por las recientes alteraciones de la Selva Atlántica Interior en Brasil, como lo ha expuesto Giraudo (2004). Los ambientes de tacuarales densos son los que albergan estas “novedades” y en realidad parecen ser los últimos refugios australes para un número de especies endémica de esta región y que se ven amenazadas por la destrucción en los países lindantes.
La selva de galería tiene gran importancia por su carácter vinculante entre ecoregiones. Además, no existen barreras, salvo las originadas por el hombre, que impidan llegar a gran parte de las especies de selva de galería hasta el Delta del Paraná en la provincia de Buenos Aires. Pero se encuentra en grave peligro, ya que es restringida a angostas franjas a lo largo del Río Uruguay mediante el uso del fuego en la época seca, para favorecer el crecimiento de pasturas para el ganado. Las aves registradas en Santo Tomé contienen tres especies potencialmente vulnerable (Psilorhamphus guttatus, Amaurospiza moesta y Emberizoides ypiranganus), tres vulnerables (Spizastur melanuleuca, Xolmis dominicana y Culicivora caudacuta) y dos especies en peligro (Anthus natereri y Xantopsar flavus) (Garcia Fernández et al. 1997) Merecen especial tratamiento especies como Amaurospiza moesta, que parece ser exclusiva de los tacuarales y además es considerada rara, tanto en el país (Narosky e Yzurieta, 2003) como en la Selva Atlántica (Ridgely y Tudor, 1989).
La diversidad de especies depende en gran parte de que la selva sea contínua, comunicando zonas y permitiendo el desplazamiento de las aves migratorias. Se trata de una zona de tránsito intenso de migrantes “conducidos” entre los dos grandes ríos del litoral en sus vuelos hacia el norte. Estos desplazamientos en el litoral han sido mencionados para algunas especies como Elaenias (Partridge 1964). Pero un importante número de especies nidificantes en la región austral de Sudamérica migra hacia el norte luego de criar (Narosky e Yzurieta 2003). Estudios en Brasil, especialmente en el Pantanal del Mato Grosso (Willis y Oniki 1990) identifican a numerosas especies del sur como visitantes de invierno. Entre las especies nidificantes en el Litoral Argentino mencionadas como migratorias hacia los extensos humedales del sudoeste de Brasil, se encuentran varias del género Sporophila y al menos 3 especies de Turdus, 10 de tiránidos y varias especies de golondrinas. Todas las migraciones se podrían haber retrasado por la intensa sequía que afectó esta zona. Las lluvias de primavera y verano llegaron recién al comienzo del otoño.
Es necesario tomar a las selvas de galería como zonas de prioridad de conservación, incluyendo los mogotes y las islas del Río Uruguay en Corrientes. No solo porque albergan una rica avifauna, sino también porque son fundamentales como corredores biológicos para el mantenimiento de la biodiversidad en las provincias litorales más australes.
La presencia de Knipolegus cyanirostris, Gubernetex yetapa, Culicivora caudacuta, Stelgidopteryx ruficollis, Donacobius atricapillus, Sporophila collaris, Emberizoides ypiranganus, Emberizoides herbicola, Agelaius cyanopus, Pseudoleistes guirahuro y Xanthopsar flavus en las mismas parcelas le dan un alto valor a estos humedales por la rareza creciente de estas especies.
Agradecimientos
Agradecemos a los propietarios de Estancia La Blanca, John y sus hijos Irene y Johnny Field por su
hospitalidad durante nuestra estadía. El viaje forma parte de un Proyecto de Biodiversidad del Litoral Argentino,
dirigido por el Dr. Florencio Aceñolaza con fondos de la Secretaría de Ciencia y Técnica de la Nación.
Agradecemos a Leonor Guardia Claps, Patricia Albornoz y a Christian Lane por su participación en el primer viaje
y ayuda de campo. El trabajo no hubiera sido posible sin el equipo provisto por el Dr. Ruben Barquez, Director
del PIDBA (Programa de Investigaciones de Biodiversidad Argentina) de la Universidad Nacional de Tucumán.
Bibliografía
Cabrera, A. L., y A. Willink. 1973. Biogeografía de América Latina. Serie de Biología. O.E.A., 13:120.
Canevari, M.; G. R. Carrizo; G. Harris; J. Rodriguez Mata y R. J. Straneck. 1991. Nueva guía de las aves Argentinas. Tomo I I . Fundación Acindar, Buenos Aires, Argentina.
Chebez, J. C., N. R. Rey, M. Babarskas y A. G. Di Giacomo. 1998. Las Aves de los Parques Nacionales de las Argentina. Administración de Parques Nacionales y Asociación Ormitológica del Plata. Monografía especial L.O.L.A. 12:127 p. Buenos Aires.
Contreras, J. R. 1979a. Avifauna correntina I. Aratinga nenday (Vieillot) y Megarhynchus pitangua pitangua (Linne) (Aves, Psittacidae y Tyrannidae). Historia Natural 1(2):5-8.
Contreras, J. R. 1981. Lista preliminar de la avifauna correntina.I. No Passeriformes. Historia Natural, 2 (3):21-28.
Contreras, J. R. 1983a. Notas sobre el peso de aves argentinas. II. Historia Natural 3 (4):39-40.
Contreras, J. R. 1986a. Acerca del Milanito Blanco, Gampsonyx swainsoni swainsoni Vigors, 1835, en la Argentina (Aves, Accipitridae). Historia Natural 6(9):83-84.
Contreras, J. R. 1986b. Sobre la presencia del halconcito gris, Spiziapteryx circumcinctus (Kaup) en la provincia de Corrientes, Argentina (Aves, Falconidae). Historia Natural 6(10):91-92.
Contreras, J. R. 1987. Lista preliminar de la avifauna correntina.II. Passeriformes. Historia Natural, 7 (6):61-70.
Contreras, J. R., y A. O. Contreras. 1984. Addenda de la lista de aves No Passeriformes de la provincia de Corrientes, Argentina. Historia Natural, 3(28):248.
Darrieu, C.A. 1986. Estudios sobre la avifauna e Corrientes. III. Nuevos registros de aves Passeriformes (Dendrocolaptidae, Furnariidae, Formicariidae, Cotingidae y Pipridae) y consideraciones sobre su distribución geográfica. Historia Natural, 6:93-99.
Darrieu, C. A. 1987. Estudios sobre la Avifauna de Corrientes. IV. Nuevos Registros de Aves (Passeriformes, Tyrannidae) y Consideraciones sobre su Distribución Geográfica. Neotrópica, 33(89):29-36.
Darrieu, C. A. y A. R. Camperi. 1988. Estudios sobre la avifauna de Corrientes. V. Passeriformes poco citados (Parulidae, Thraupidae). Neotrópica, 36:133-137.
Darrieu, A. C. y A. R. Camperi. 1990. Estudio de una colección de aves de Corrientes. I.(Dendrocolaptidae - Furnariidae). El Hornero, 13 (2):138-146.
Darrieu, C. A. y A. R. Camperi. 1991. Estudio de una colección de aves de Corrientes. II. (Formicariidae, Cotingidae, Pipridae). Neotrópica, 37 (97):75-80.
Darrieu, C. A. y A. R. Camperi. 1993. Estudio de una colección de aves de Corrientes. IV. (Phytotomidae a Parulidae). Neotrópica, 39 (101-102):83-92.
Darrieu, C. A. y A. R. Camperi. 1994. Estudio de una colección de aves de Corrientes: Thraupidae e Icteridae. Neotrópica, 40 (103-104):49-55.
Darrieu, C.A. y A.R. Camperi. 1996. Estudio de una colección de aves de Corrientes (Emberizidae y Fringillidae). Neotrópica 42 (107-108):69-75.
Darrieu, C. A y M. M. Martinez. 1984. Estudios sobre la avifauna de Corrientes. I. Nuevos registros de aves (No Passeres). Revista del Museo de La Plata, Nueva Serie, Zoología, 13 (145):257-260.
Fraga, R. M. 1996. Sección Aves. Pp. 155-219, en García Fernández, J. J.; R. A. Ojeda; R.M. Fraga; G.B. Díaz & R.J. Baigún (Compiladores). Libro Rojo de Mamíferos y Aves amenazados de la Argentina. Buenos Aires, FUCEMA, 221 p.
Fraga, R. M. 2001. The avifauna of Estancia San Juan Poriahú, Iberá Marshes, Argentina: Checklist and some natural history notes. Cotinga 16:81-86.
Giraudo, A. R. y M. Sironi. 1992. Registro de Pteroglossus castanotis australis Cassin, 1867 y de Baillonius bailloni (Vieillot, 1819) (Aves: Ramphastidae) en el noreste de la Provincia de Corrientes, República Argentina. Nótulas Faunísticas, (25):1-2.
Giraudo, A. R y H. Povedano. 2004. Avifauna de la región biogeográfica Paranaense o Atlántica Interior de Argentina: biodiversidad, estado del conocimiento y conservación. Insugeo, Miscelánea, 12:331–348.
Giraudo, A. R, M L. Chatellenaz, C. A. Saibene, M. A. Ordano, E. R. Krauczuk, J. Alonso y A.S. Di Giacomo. 2003. Avifauna del Iberá: Composición y datos sobre su historia natural.Pp. 195-223. Giraudo A. R. (Coord.). Unidad de Avifauna. En: Alvarez, B. B. (Ed.). Fauna del Iberá. Editorial de la Unversidad Nacional del Nordeste, Talleres Gráficos Volpe/Fox, Buenos Aires.
Marini, M. A. y R. B. Cavalcanti. 1990. Migraçôes de Elaenia albiceps chilensis e Elaenia chiriquensis albivertex (aves: Tyrannidae). Boletín Museo Paranese Emilio Goeldi, Serie Zoologia 6(1).
Myers, N., R. A. Mittermeier, C. G. Mittermeier, G. A. B. Fonseca y J. Kent. 2000. Biodiversity hotspot for conservation priorities. Nature 403:853–858.
Partridge, W. H. 1962. Dos aves nuevas para la fauna argentina. Neotrópica, 8 (25):37-38.
Partridge, W. H. 1963. Nota sobre un ave nueva para la fauna argentina. Neotrópica, 9 (29):64.
Partridge, W. H. 1964. Notas sobre la presencia de Elaenia chiriquensis y Tangara cayana en la avifauna argentina, con comentarios sobre Tangara arnaulti Berlioz. Neotrópica, 10 (31):37-38.
Short, L. L. 1971. Aves nuevas o poco comunes de Corrientes, República Argentina. Revista del Museo Argentino de Ciencias Naturales, Zoología, 9:283-309.
Short, L. L. 1975. A Zoogeographic Analysis of South American Chaco Avifauna. Bulletin of the American Museum of Natural History 154 (3):165-352.
Silva, J. M. C. 1996. Distribution of Amazonian and Atlantic bird in the gallery forests of the Cerrado Region, South America. Ornitologia Neotropical 7:1-18.
Stotz, D. F., Fitzpatrick, J. W., Parker III, T. A. and D. F. Moskovits. 1996. Neotropical birds. Ecology and conservation. The University Chicago Press, Chicago and London. 478 pp.Bulletin American Museum of Natural History, 154 (3):163-352.
Verea, C., A. Fernández-Badillo y A. Solórzano. 2000. Variación en la composición de las comunidades de aves de sotobosque de dos bosques en el norte de Venezuela. Ornitología Neotropical, 11:65-79.
Willis, E. O., & Y. Oniki. 1990. Levantamento preliminar das aves de inverno en dez áreas do sudoeste de Mato Grosso, Brasil. Ararajuba, 1:19-38.