Ecología alimentaria de algunas especies de Passeriformes (Furnariidae, Tyrannidae, Icteridae y Emberizidae): consideraciones sobre algunos aspectos del nicho ecológico 1
Viviana G. ALESSIO 2 , Adolfo H. BELTZER 3 , Rafael C. LAJMANOVICH 4 , Martín A. QUIROGA 4
1 Este Trabajo es parte de la tesis de grado del primer autor.
2 Pasante INALI, Alumna Maestría en Ecología, Facultad de Ciencia y Tecnología (UADER), Paraná, Entre Ríos E-mail: vialessio@yahoo.com.ar
3 Investigador del CONICET, Instituto Nacional de Limnología (INALI - CONICET - INL). José Maciá 1933, 3016 Santo Tomé, Santa Fe. - E-mail: adolfohec2001@yahoo.com.ar - lajmanovich@hotmail.com
4 Becario del CONICET, Instituto Nacional de Limnología (INALI - CONICET - UNL) E-mail: mquiroga@ssdfe.com.ar
Abstract: FEEDING ECOLOGY OF PASSERINE SPECIES (FURNARIIDAE, TYRANNIDAE, ICTERIDAE AND EMBERIZIDAE): CONSIDERATIONS ON ASPECTS OF THEIR ECOLOGICAL NICHE. Aspects related to the feeding ecology of thirteen passerine birds species belonging to families: Furnariidae (Certhiaxis cinnamomea , Phacellodomus ruber, Schoeniophylax phryganophila), Tyrannidae (Xolmis coronata, Satrapa icterophrys, Tyrannus melancholicus, Machetornis rixosus, Tyrannus savana), Icteridae (Cacicus solitarius, Icterus cayanensis, Molothrus rufoaxilaris) and Emberizidae (Coryphospingus cucullatus, Zonotrichia capensis) are presented in the present manuscript. This study was undertaken to investigate the feeding ecology of mentioned species by quantifying the trophic spectrum, spatial and temporal dimensions of the niche breadth, circadian rhythm of feeding activity and habitat selection, stating as a null hypothesis that, studied passerines species, lack mechanisms to segregate each other (not allowing coexistence among them) and as the alternative hypothesis the presence of those mechanisms. Captures and field observations were conducted by INALI at Carabajal Island (Santa Fe, Argentina, 31º 39´S – 60º 41´W) as part of exploratory samples carried out on years 1981, 1982, 1983, 1984, 1985, 1989, 1990 and 1991. The contribution of each food category to the trophic spectrum, seasonal variations, trophic niche amplitude, circadian rhythm of feeding activity, prey size, feeding efficiency, habitat preference and a dendogram of similarities were estimated and calculated by the application of different qualitative indexes and other statistical tools. Results reveal that insects are one of the main ingested items followed by seeds. Other types of foods were just accessories. This data represent valuable information to the knowledge of the thirteen studied species.
Key words: Birds - Feeding Ecology - Parana River.
Palabras clave: Aves - Ecología alimentaria - Río Paraná.
Introducción
Los ecosistemas acuáticos representan un buen medio para documentar las respuestas de las aves y sin embargo son escasos los estudios sobre Passeriformes (a excepción de algunas especies), que en este sentido, se han llevado a cabo en el valle de inundación del río Paraná (Beltzer, 1995). Según Maitland (1978) y Martínez (1993), pocas aves pueden ser consideradas como completamente acuáticas.Aproximadamente ocho de los veintiocho órdenes actuales (Ziswiler, 1980) presentan ajustes morfológicos y fisiológicos relacionados con la vida en ambientes acuáticos. Uno de los órdenes que precisamente no revela vinculación con el sistema acuático del Paraná es el de los Passeriformes conocidos como pájaros y que sin embargo presentan asociación estrecha a algunas unidades de ambiente y vegetación (GUVAS) (Beltzer y Neiff, 1992) del sistema como lo son el bosque en galería, el monte, el pastizal y hasta la vegetación acuática. Algunas especies ya estudiadas documentan lo mencionado, tal el caso de Cinclodes fuscus (remolinera común) (Beltzer, 1997), Pitangus sulphuratus (benteveo) (Beltzer, 1983d; Latino y Beltzer, 1999).
El interés por definir la función que estos vertebrados cumplen en un sistema tan complejo, expuesto a modificaciones antrópicas de incierto impacto, crean ante el concepto de nicho ecológico el interés por definir las relaciones que se establecen alrededor de los recursos tróficos. En tal sentido, las evidencias obtenidas sobre la alimentación de las aves corroboran ampliamente las proposiciones planteadas por Root (1968), haciendo notar que los tipos de presa, su tamaño e identificación, así como la eficiencia en la captura son variables fundamentales en el estudio de la dimensión trófica del nicho (Subnicho trófico) y de las relaciones interespecíficas en un mismo gremio (Cody, 1975a-b; Wilson, 1974; Jordano, 1981; Magurran, 1989; Begon, 1989; Begon, et al., 1988).
Durante la década pasada, tanto biólogos como especialistas en el manejo de vida silvestre, han tomado cada vez mayor conciencia de la importancia que tiene el conocimiento en el campo de la fisiología y la alimentación como base indispensable para comprender la ecología de las especies. Además del subnicho trófico, dada la importancia de las aves como consumidoras (Martínez, 1993), como la importancia de la relación entre su tamaño corporal, requerimientos energéticos y niveles de actividad (Margalef, 1977, 1983) resulta también de gran interés cómo efectúan la utilización espacial diferencial del ambiente o ecoespacio, como las horas del día, es decir qué tipo de modelo diferencial de actividad temporal es utilizada (Pianka, 1982).
Por todo lo expresado y en la convicción de que la simple localización de las aves en las grandes unidades de vegetación y ambiente (GUVAS) no es criterio suficiente para determinar el grado de dependencia y considerando el importante papel que las aves desempeñan en la transferencia de energía (Margalef, 1983), es fundamental dar especial atención a los estudios que definan sus nichos ecológicos.
Se estudió la biología alimentaria de algunas especies de las Familias Furnariidae, Tyrannidae, Emberizidae e Icteridae en aspectos que hacen a su rango trófico, amplitud del nicho trófico, espacial y temporal, eficiencia alimentaria, ritmo de actividad circadiana y selección del hábitat. Las especies que se consideraron para este estudio fueron:
Fam. FURNARIIDAE: Certhiaxis cinnamomea (Vieillot, 1817), Phacellodomus ruber (Vieillot, 1817),Schoeniophylax phryganophila (Vieillot, 1817)
Fam. TYRANNIDAE: Xolmis coronata (Vieillot, 1823), Satrapa icterophrys (Vieillot, 1818), Tyrannus melancholicus Vieillot, 1819, Machetornis rixosus (Vieillot, 1819), Tyrannus savana Vieillot, 1807
Fam. EMBERIZIDAE: Coryphospingus cucullatus (Sawinson, 1825), Zonotrichia capensis (Hellmayr, 1932)
Fam. ICTERIDAE: Cacicus solitarius (Vieillot, 1816), Icterus cayenensis Vieillot, 1819, Molothrus rufoaxilaris Cassin,1866.
Se plantea como objetivo investigar la biología alimentaria de las especies señaladas precedentemente, cuantificando el espectro trófico, amplitud del nicho trófico, ritmo circadiano de actividad alimentaria selección del hábitat y relaciones tróficas.
Material y Métodos
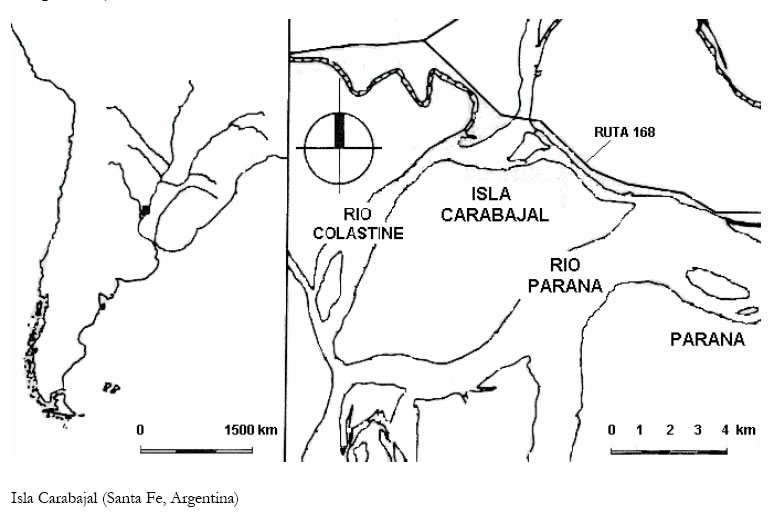
ÁREA DE ESTUDIO
Las especies utilizadas para esta investigación, fueron capturadas en la Isla Carabajal (Provincia de
Santa Fe, 31º39’S - 60º42’W), perteneciente a la región Neotropical, subregión Chaqueña, provincia
de la Pampa (Morrone, 2001) cuya superficie es de aproximadamente 4000 ha. En ella se observan
numerosos cuerpos de agua leníticos, algunos de considerable extensión, como la laguna La Cuarentena,
laguna La Cacerola, laguna La Vuelta de Irigoyen y laguna el Puesto. El clima del área es
templado lluvioso, caracterizado por una temperatura media de 18,1º C y un rango promedio anual
de 45º C, con una media de 24,5º C en el mes más caluroso (Enero) y de 11,3º C en el mes más frío
(Julio). Los veranos son muy calurosos con un registro máximo de temperatura de 44ºC (Iriondo y
Drago, 1972) y un promedio de lluvias anuales de aproximadamente 1000 mm (D’Angelo, 1997).
Los vientos prevalecen del sector NE, E y SE.
Esta isla corresponde a la unidad geomorfológica denominada llanura de bancos (Iriondo y Drago, 1972).

Las grandes unidades de vegetación y ambiente (GUVAS) han sido separadas según los criterios y terminologías de contribuciones realizadas anteriormente para el río Paraná (Beltzer, 1981; 1983 a, b, c; 1984 a, b; 1985; 1990 a, b; 1991; Neiff, 1975; 1978; 1986 a, b).
Para este estudio se consideraron las siguientes GUVAS: vegetación acuática (flotante, arraigada); albardón; bosque en galería; pajonal; pastizal; monte blanco.
Vegetación acuática flotante y arraigada: ocupa la mayor extensión, con variaciones que dependen del nivel hidrométrico (Neiff, 1975, 1978, 1986b). Las especies más frecuentes son: Eichhornia crassipes, E. azurea, Azolla sp., Salvinia sp., Pistia stratiotes, Paspalum sp., Echinochloa sp., Ludwigia peploides, Polygonum sp. La fauna asociada a los hidrófitos representa una oferta importante para las aves.
Albardón: corresponde a la franja de tierra alta (Burkart 1957) que sigue el curso de los cuerpos de agua, y donde la mayoría de las aves obtienen su alimento, caminando.
Bosque en galería: se encuentra siguiendo el curso de los ríos y los diques marginales de los derrames laterales producidos por las crecientes. Las especies vegetales típicas son: Salix humboldtiana y Tessaria integrifolia propia de los albardones incipientes, en tanto que aquellos más altos registran la presencia de otras especies como Erythrina crista – galli, Nectandra falcifolia, Cathormion polyanhtum, Sapium haematospernum, y pastizales con Baccharis sp., Sida rombifolia, Aspilia silphioides, y enredaderas como Ipomea sp., Muehlenbeckia sagittifolia, Mikania periplocifolia y estrato herbáceo, con dominancia de gramíneas bajas (Neiff y Orellana, 1972).
Pajonal: la vegetación palustre tiene como especie dominante a Panicum prionitis, pudiendo observarse además Schoenoplectus californicus, y Thypa sp., en ambientes conocidos como bañados (Neiff y Orellana, 1972), con un gran elenco faunístico en la vegetación acuática, cuando este ambiente se cubre de agua (de 3 a 6 meses).
Pastizal: es una formación herbácea de contacto entre la selva en galería y el pajonal (Beltzer y Neiff, 1992), caracterizado por gramíneas bajas, inundable por períodos menores que seis meses, es un ambiente donde hay abundancia de semillas y fauna asociada a los vegetales, en especial insectos y arácnidos.
Monte blanco: en los albardones altos y arenosos la vegetación típica está constituida por poblaciones arbóreas como Acacia caven, Erythrina crista - galli, Nectandra falcifolia, Sapium haematospermun, Croton urucurana y otras (Neiff y Orellana, 1972). Para este ambiente puede distinguirse el estrato inferior que corresponde a la vegetación herbácea, un estrato arbustivo y uno o dos estratos de árboles. En este ambiente la mayoría de las aves obtienen su alimento explorando troncos, ramas y hojas, ya sea caminando o desde el aire. (Beltzer y Neiff, op.cit.).
Metodología
Para el análisis de los contenidos estomacales se utilizaron las muestras depositadas en el laboratorio de aves acuáticas pertenecientes a la colección del Instituto Nacional de Limnología (INALI – CONICET- UNL).
Las capturas de los ejemplares utilizados para este estudio, se efectuaron con arma de fuego, en el período 1981-1991. Las aves colectadas fueron colocadas en bolsas plásticas; se les inyectó formol al 10% en la cavidad abdominal, para evitar que continúe el proceso digestivo. Estas capturas fueron realizadas con fines científicos y contaron con la autorización del Ministerio de Agricultura y Ganadería (MAGIC) a través de la Dirección de Ecología y Protección de la Fauna de la Provincia de Santa Fe. A campo se les tomó el peso, fecha, hora, año de captura, sexo y unidad ambiente de cada una; para aquellas especies que no se contó con los datos del peso, se recurrió a la bibliografía, obteniéndose de este modo el peso promedio (de la Peña, com. pers; Fiora, 1934; Contreras y Davies, 1980; Contreras, 1983; Belton,1984; Salvador, 1988 ). Hasta el momento de la disección y la identificación del espectro trófico, las muestras fueron conservadas en un freezer. En el laboratorio se procedió a separar el estómago del resto del tubo digestivo con un bisturí, y se tomaron los datos correspondientes al peso del estómago lleno (con contenido), y peso del estómago vacío (sin contenido) con una balanza Mettler M10; el volumen del contenido estomacal, se calculó por desplazamiento de agua, con una probeta Pyrex de 25 cc., luego fueron colocados en frascos con formol al 10% para su posterior análisis cuali-cuantitativo. Para realizar las observaciones de los diversos contenidos se contó con una lupa estereoscópica Olympus 40x.
Mediante la aplicación de diversos recursos de análisis cuantitativo y estadístico, se estableció el valor de cada categoría de alimento a la composición del espectro trófico, variaciones estacionales, amplitud del nicho trófico, ritmo diario de actividad alimentaria, tamaño de presas, eficiencia alimentaria y preferencia de hábitat. El índice de importancia relativa (IRI) para los distintos itemes alimentarios fue categorizado en alimentos básicos, secundarios, accesorios y ocasionales (Beltzer, 1998).
Con el objeto de determinar la diversidad trófica se siguió el criterio de Hurtubia (1978), que consiste en calcular la diversidad trófica (H) para cada individuo, utilizando la fórmula de Brillouin (1965):
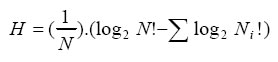
donde N es el número total de entidades taxonómicas halladas en el estómago de cada individuo y Ni es el número total de presas de la especie i en cada estómago. Las estimaciones individuales se sumaron al azar, obteniéndose la diversidad trófica acumulada (Hk) en busca del punto t (según Magurran, 1989), cuya asíntota representa la muestra mínima cuali-cuantitativa.
Los contenidos estomacales se estudiaron individualmente, identificándose y cuantificándose los organismos a distintos niveles taxonómicos. Para el conteo de las ingestas en avanzado estado de digestión se consideraron como individuos, aquellos que conservaron estructuras o piezas claves para su identificación, tales como cabezas, mandíbulas, élitros, glumas, etc.
Con el objeto de determinar la contribución de cada categoría de alimento a la dieta de la especie, se aplicó el índice de importancia relativa (IRI), según el criterio de Pinkas et al., 1971:
![]()
donde FO es la frecuencia de ocurrencia de una categoría de alimento; N es el porcentaje numérico y V el porcentaje volumétrico.
La amplitud del nicho trófico se calculó mediante el índice de Levins (1968):
![]()
donde pìj es la probabilidad del ítem i en la muestra j.
Con la finalidad de establecer el ritmo circadiano de actividad alimentaria, se calculó el índice medio de saciedad (IF) medido como el volumen de los contenidos estomacales en mililitros sobre el peso corporal del ave en gramos, para cada tiempo de captura (Maule y Horton, 1984).
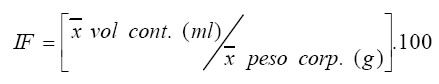
La eficiencia alimentaria se obtuvo según la expresión de Acosta Cruz, et al. (1988):
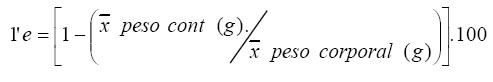
Con el objeto de establecer la asociación de la especie a las grandes unidades de vegetación y ambiente (GUVAS), se aplicó el índice de preferencia de hábitat (Pi) siguiendo el criterio de Duncan (1983):
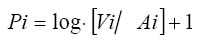
donde Vi es el porcentaje de individuos registrados en cada unidad de ambiente y Ai es el porcentaje de cobertura correspondiente a cada unidad de ambiente. Los valores obtenidos que superan el 3% indican una alta preferencia por una determinada GUVA, en tanto que valores inferiores señalan una menor selectividad.
Las relaciones tróficas se compararon utilizando el análisis de agrupamiento UPGMA, aplicando el índice de similitud semicuantitativo de Sorensen y donde cada especie estudiada constituyó una unidad taxonómica operativa (OTU). Los análisis se realizaron con el programa MVSP. (Kovach, 1999). Este coeficiente genera valores entre 0 y 1, siendo 1 el valor de máxima similitud.
Resultados y Discusión
CERTHIAXIS CINNAMOMEA (CURUTIÉ ROJIZO)
Todos los estómagos analizados (n =7), pertenecientes al período 1990-1991, contuvieron
alimento. El espectro trófico basado en la identificación de 54 presas, resultó compuesto por doce
(12) entidades taxonómicas, de las cuales nueve (9) pertenecen a la fracción animal, y las tres (3)
restantes a la fracción vegetal. (Tabla 1).
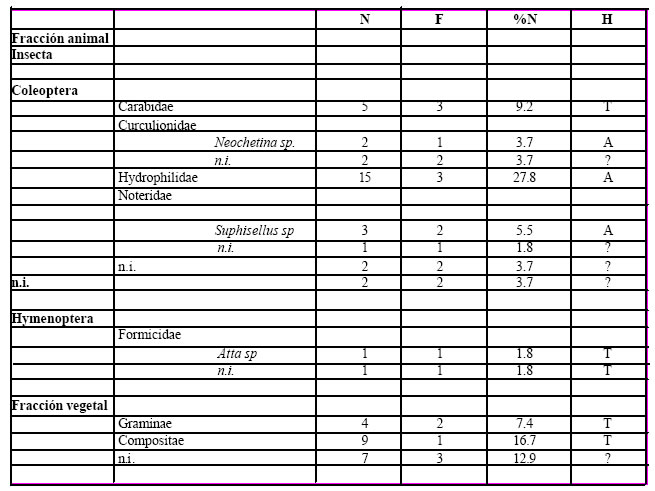
Tabla 1. Espectro trófico de Certhiaxis cinnamomea. N = nº de organismos; F = frecuencia de captura; % = porcentaje numérico; H = hábitat (A: acuático, T: terrestre); ni = no identificado.
De la fracción vegetal se hallaron un total 20 semillas representadas por Graminae y Compositae no identificadas, sin dudas que las gramíneas pertenecen a las especies típicas de los albardones comúnmente denominados canutillos como así también las Compositae, las semillas no identificadas fueron siete. En total la fracción vegetal representó el 37% del espectro hallado. La fracción animal fue tanto numérica como taxonómicamente la más importante, representando el 63% del total. Todos los alimentos ingeridos correspondieron a insectos, algunos pertenecientes a formas acuáticas tales como Hydrophilidae que fueron los más numerosos, Curuculionidae con Neochetina sp. y Noteridae con Suphisellus sp.; en tanto que las formas terrestres representadas por Carabidae y Formicidae con Atta sp., fueron menos numerosas. También se registraron algunos restos de insectos que no fueron identificados.
Los valores de diversidad trófica (H) oscilaron entre 0,5 y 1,76, siendo los de mayor ocurrencia los pertenecientes al intervalo de alta diversidad (1,01 - >2,00); en tanto que, la diversidad media fue de 0,95. La diversidad trófica acumulada (Hk) tuvo un valor de 2,79. La sumatoria de las muestras al azar dan una tendencia de manifiesto crecimiento exponencial por lo que no alcanza la asíntota requerida (P. t, Magurran, op.cit.). (Fig.1).
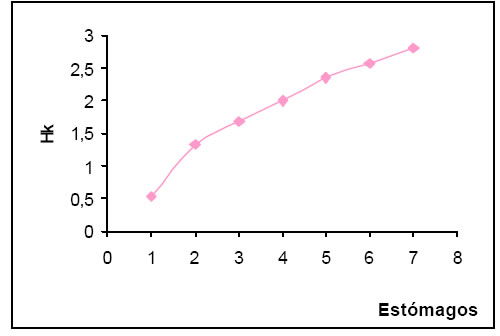
Fig. 1. Diversidad trófica acumulada (Hk) de Certhiaxis cinnamomea.
Por medio de la aplicación del índice de importancia relativa para determinar la contribución de
cada categoría de alimento a la dieta de las especies, se obtuvieron los siguientes valores:
Coleoptera = 10478; Semillas = 970; Hymenoptera (Formicidae) = 30 (Fig.2).
Dichos valores proporcionan una visión del régimen alimentario del ave y destacan la importancia que tienen los Coleoptera, y dentro de estos los Hydrophilidae, Carabidae y Curculionidae, tanto en ocurrencia como volumétrica y numéricamente. Las semillas, constituyen una categoría secundaria, y los Hymenoptera (Formicidae) alimentos accesorios.
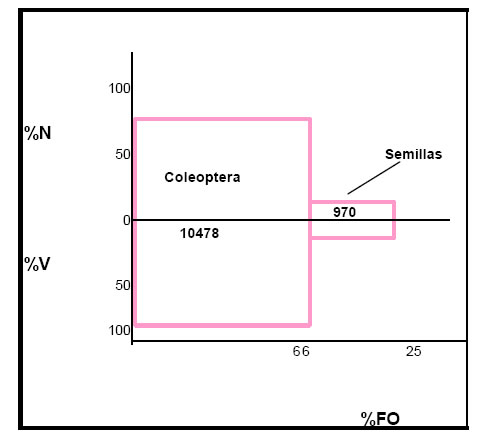
Fig. 2. Índice de importancia relativa (IRI) de Certhiaxis cinnamomea. %N = porcentaje numérico; %V = porcentaje volumétrico; %FO = frecuencia de ocurrencia.
Los valores correspondientes a la amplitud del nicho trófico fueron los siguientes: 0,84 para otoño, 0,78 para invierno, y 0,78 para verano; no se efectuaron los cálculos para la primavera porque no hubo capturas en dicha estación. Estos valores indican que se mantiene uniforme durante los tres períodos con muestras homogéneas. La eficiencia alimentaria (l´e) fue del 97%; este valor, revela el ajuste de la especie con el medio. En referencia al ritmo circadiano de actividad alimentaria (IF), se observó un patrón que presenta mayor actividad en las primeras horas del día, manteniéndose constante hasta las 18:00 horas.
El tamaño de las presas osciló entre 1 y 7 mm, siendo más frecuentes las comprendidas en el
intervalo (2,5 - 4), y que correspondieron, dentro de la fracción animal, a algunos Coleoptera
(Curculionidae, Hydrophilidae) y dentro de la fracción vegetal a las Graminae y algunas semillas no
identificadas. Las presas de menor tamaño, estuvieron representadas por insectos no identificados,
por Formicidae (con Atta sp.) y por semillas no identificadas y de Compositae; en tanto que las presas
de mayor tamaño fueron los Coleoptera, en su mayoría representados por Carabidae e Hydrophilidae.
Los valores obtenidos para la preferencia de hábitat (PI), fueron: 0,4 para el bosque en galería y
0,13 para el monte.
Ordano et al. (1999) indica para el norte de Argentina una dieta compuesta por larvas de Lepidoptera, Orthoptera, Gryllidae, Hemiptera, Pentatomidae, Coleoptera (Curculionidae); Hymenoptera (Formicidae, Camponotus sp.). Este aporte constituye el único que llega a una resolución taxonómica que en algunos ítemes alimentarios alcanza hasta la identificación de género. En cambio los antecedentes restantes describen los grandes grupos de organismos que componen la dieta de este furnárido. Canevari et al. (1991a-b) señalan como patrón de conducta en su alimentación, que recorre ágilmente la vegetación acuática en busca de pequeños invertebrados. De la Peña (1993) menciona que frecuenta montes húmedos donde se alimenta de insectos, categoría que también le asigna Brooks (1997). Todas las capturas y observaciones de su comportamiento fueron efectuadas en los denominados "enriedos", que constituyen unidades de vegetación palustre cerrada junto al bosque en galería en los albardones. Estas observaciones coinciden con lo indicado por Olrog (1979) que lo menciona como propio de los totorales y vegetación arbustiva acuática de lagunas y esteros; de comportamiento inquieto y hasta confiado (Klimatis y Moschione, 1987; Narosky e Izurieta, 1993; Canevari et al., 1991a-b) lo mencionan como palustre, inquieto y confiado. Por tratarse de una especie que ingiere principalmente insectos de pequeño tamaño capturados tanto en follaje terrestre (principalmente albardones) y en la vegetación acuática se lo incluye siguiendo en parte el criterio Kirkconnel et al., (1992) en el gremio de los básicamente insectívoros de follaje por espigueo.
PHACELLODOMUS RUBER (ESPINERO GRANDE)
Todos los estómagos analizados (n =13), correspondientes a los períodos 1981-1982-1983-
1985-1989-1990-1991, contuvieron alimento. Del espectro trófico, se identificaron 176 presas, las que
estuvieron representadas por veinte (20) entidades taxonómicas, de las cuales diecisiete (17), correspondieron
a la fracción animal y las restantes, tres (3) a la fracción vegetal. (Tabla 2).
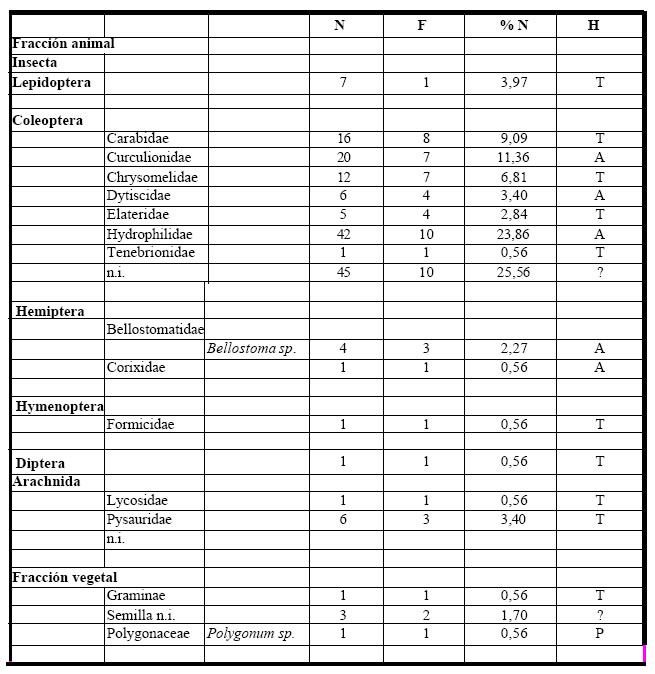
Tabla 2. Espectro trófico de Phacellodomus ruber. N = nº de organismos; F = frecuencia de captura; % = porcentaje numérico; H = hábitat (A: acuático, T: terrestre, P: palustre); ni = no identificado.
La fracción animal fue la más importante taxonómicamente como numéricamente, representando el 85% del total de las presas; dentro de los Coleoptera identificados, se destacan insectos acuáticos asociados a la vegetación tales como Hydrophilidae, en tanto que los restantes representan formas tanto terrestres como vinculadas al agua (Curculionidae, Dytiscidae, Bellostomidae, Chrysomelidae, Elateridae y Carabidae). Las restantes ingestas registraron valores menores, donde se destacan dentro de los insectos Hymenoptera y Diptera, en tanto que los Arachnida estuvieron representados por Pysauridae y Lycosidae. La fracción vegetal, con escasa representación (15%), registró especies acuáticas arraigadas como Polygonum sp. y Graminae.
La diversidad trófica (H) por estómago varió entre 0,65 y 2,99, siendo más frecuentes los comprendidos en el intervalo de clase de alta diversidad (1,01 - >2,00). El valor medio de diversidad trófica fue de 1,74. La diversidad trófica acumulada (Hk) fue de 2,59. Con la suma de las trece muestras, la curva tiende a la estabilización lo que permitiría alcanzar el punto t (Magurran, 1989) y que estaría indicando la muestra mínima.(Fig.3).
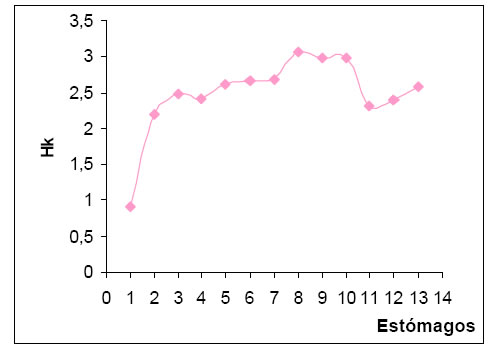
Fig. 3. Curva de diversidad trófica acumulada (Hk) de Phacellodomus ruber.
La contribución de cada categoría de alimento obtenida por la aplicación del índice de importancia relativa (IRI), fue la siguiente: Coleoptera = 14396; Arachnida = 87; Semillas = 20; Lepidoptera = 12; Otros (Hymenoptera y Diptera) = 4 (Fig.4).
Dichos valores permiten observar que los Coleoptera constituyen la dieta básica del ave, en tanto que los grupos restantes son categorías accesorias de la dieta.
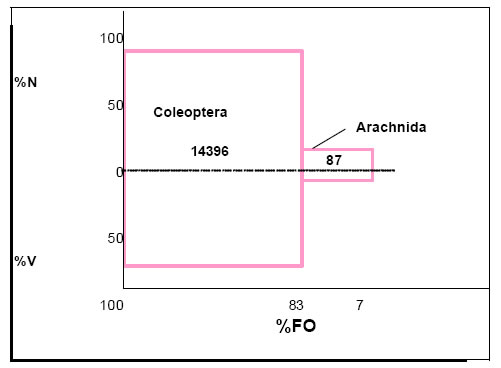
Fig. 4. Índice de importancia relativa (IRI) de Phacellodomus ruber. %N = porcentaje numérico; %V = porcentaje volumétrico; %FO = frecuencia de ocurrencia.
La amplitud del nicho trófico (AN) arrojó los siguientes valores: 0,22 para primavera, 0,78 para invierno, 0,6 para verano y 0,8 para otoño. En primavera, la muestra está maximizada por la dominancia de Lepidoptera y Coleoptera no identificados, en tanto que los ítemes restantes son ostensiblemente menores. Los altos valores registrados en invierno, verano y otoño, indican que las muestras son más homogéneas. La eficiencia alimentaria (l'e) fue del 97%. En lo que hace al ritmo circadiano de actividad alimentaria se observó un patrón que presenta mayor actividad entre las 08:00 y las 10:00, decayendo ostensiblemente hasta las 14:00, y luego ascendiendo abruptamente a partir de las 16:00 horas.
El tamaño de las presas, osciló entre 1 y 12 mm, siendo más frecuentes las correspondientes al intervalo de mayor tamaño (4,5 - >8), el cual estuvo integrado por Coleoptera (Hydrophilidae, Bellostomatidae, Curculionidae, Dytiscidae, Carabidae, Elateridae, Chrysomelidae), Arachnida (Lycosidae, Pysauridae) entre los más importantes. Los de menor talla fueron las semillas de Polygonum sp. y las Graminae, también correspondió a este intervalo algunos Curculionidae, Arachnida no identificada, e insectos no identificados.
Los valores obtenidos para la preferencia de hábitat (Pi), fueron: 0,3 para el monte y 0,29 para el bosque en galería.
La mayor parte de los informes referidos a esta especie, se basan en sus relaciones interespecíficas, comportamiento, y a su descripción (Contreras, 1980-81; de la Peña, 1993, 1994); con respecto a su dieta, Harrison (1978) lo ubica dentro del gremio de aves insectívoras de follaje por espigueo con una gran variedad de especies que demuestran con las demás especies de la familia la variedad de hábitats colonizados. El aporte que se hace es brindar los primeros datos cuantificados, que permite identificar una dieta omnívora para esta especie, basada fundamentalmente en insectos y semillas de Gramíneas y Polygonum sp., ubicándolo en el gremio de los básicamente insectívoros de follaje por espigueo.
SCHOENIOPHILAX PHRYGANOPHILA (COLUDO)
El análisis de once (n =11) estómagos, correspondientes al período 1990-1992 permitió observar
que todos contenían alimento. El espectro trófico basado en la identificación de 157 presas,
resultó estar integrado por un total de trece (13) entidades taxonómicas, doce (12) pertenecientes a la
fracción animal, y solamente una (1) a la fracción vegetal. (Tabla 3).
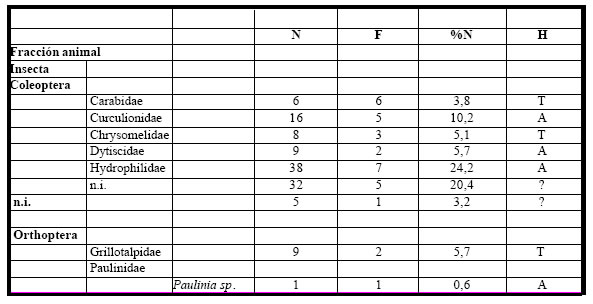
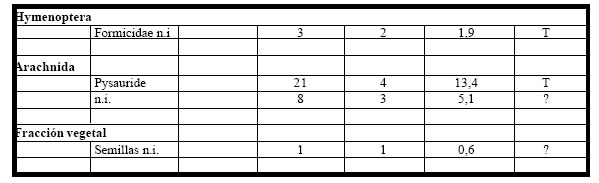
Tabla 3. Espectro trófico de Schoeniophylax phryganophila . N = nº de organismos; F = frecuencia de captura; % = porcentaje numérico; H = hábitat (A: acuático, T: terrestre); ni = no identificado.
La fracción animal fue numérica como taxonómicamente la más importante, representando el (92%) del total de las ingestas, la integraron mayoritariamente los insectos, con formas asociadas a la vegetación acuática e integrantes de la fauna del pleuston, como los Hydrophilidae, Curculionidae, Dytiscidae y Paulinidae, en tanto que las formas terrestres por los Carabidae, le siguieron los Gryllotalpidae y Chrysomelidae. Otros insectos con escasa representación numérica fueron los Formicidae y Paulinidae, al igual que los Arachnida con Pysauridae y algunas formas no identificadas, en tanto que la fracción vegetal fue la menos numerosa, con un (8%) del total y representada por semillas no identificadas.
Los valores de diversidad trófica (H) por estómago oscilaron entre 0 y 1,6. La diversidad trófica media, fue 1,05. La diversidad trófica acumulada (Hk) fue de 2,93. Con la suma de las once muestras, la curva presenta una tendencia a la estabilización, permitiendo alcanzar el punto t (Magurran, 1989). (Fig5.)
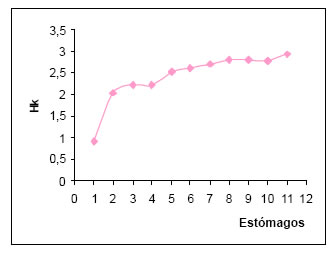
Fig. 5. Curva de diversidad trófica acumulada (Hk) de Schoeniophylax phryganophila.
La contribución de cada categoría del alimento a la dieta del ave, obtenida por la aplicación del índice de importancia relativa (IRI), fueron las siguientes: Coleoptera = 12432; Otros (Arachnida, Orthoptera y Formicidae) = 744; Semillas = 2 (Fig. 6)
Los valores de este índice, aplicado a las distintas categorías de alimento, permiten visualizar la importancia que tienen en el régimen alimentario del ave, los Coleoptera (Hydrophilidae, Curculionidae, Carabidae, Chrysomelidae, Dytiscidae); constituyendo una categoría accesoria los restantes taxa del espectro (Orthoptera con Paulinia sp. y Grillotalpidae, Formicidae y Arachnida con Pysauridae); solamente fue encontrada una semilla en un estómago, que no fue identificada y cuya ingestión se consideró accidental al incorporar las presas animales.
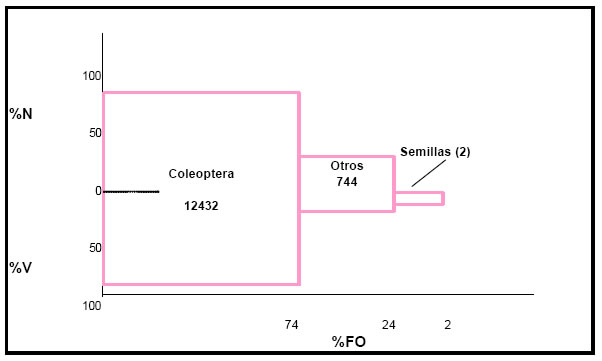
Fig. 6. Índice de importancia relativa (IRI) de Schoeniophylax phryganophila. %N = porcentaje numérico; %V = porcentaje volumétrico; %FO = frecuencia de ocurrencia.
La amplitud del nicho trófico arrojó los siguientes valores: 0,78 para verano y 0,85 para invierno, no se contó con datos de otoño y primavera. Estos valores indican que las muestras son homogéneas en ambos períodos. La eficiencia alimentaria (l´e) fue del 98 %; dicho valor indicaría el ajuste de la especie con el medio. En lo que hace al ritmo circadiano de actividad alimentaria se observó un patrón que presenta mayor actividad entre las 11:00 y las 14:00 horas descendiendo en forma manifiesta luego de las 16:00 horas.
El tamaño de las presas osciló entre 2 y 25 mm, siendo las más frecuentes las comprendidas en el intervalo de clase (4,5 - >8) y que correspondieron a los Curculionidae, Hydrophilidae, Dytiscidae, Carabidae, Gryllotalpidae y Pysauridae entre los más importantes. Los de menor talla estuvieron representados por Formicidae, algunos Carabidae y Arachnida no identificados.
Los valores obtenidos en la preferencia de hábitat (Pi) fueron de 0,3 para el bosque en galería y 0,28 para el monte.
En general, los estudios se basan en su comportamiento alimentario. Se los encuentra en parejas recorriendo árboles y arbustos bajos, en ambientes cercanos al agua, sin desechar los xerófilos (Canevari, et al., 1991b); también se encuentran breves reseñas referidas a su distribución geográfica (Baratini, 1945; Narosky e Izurieta, 1993; de la Peña, 1988a-b; Canevari et al, 1991a-b), y algunos datos sobre preferencia de hábitat (Klimatis y Moschione, 1987). Si bien, los antecedentes sobre su dieta son prácticamente nulos, (Harrison, 1978),lo ubica dentro del gremio de aves insectívoras que consumen gran variedad de insectos debido a los distintos hábitats colonizados. Siguiendo el criterio de Kirkconnel se lo incorpora en el gremio de los básicamente insectívoros de follaje por espigueo. Este estudio sobre su ecología alimentaria constituye el primer aporte al conocimiento cuali- cuantitativo para el área de inundación del río Paraná.
XOLMIS CORONATA (MONJITA CORONADA)
Del análisis de diez (n=10) contenidos estomacales, pertenecientes al período 1981-1985, se
observó presencia de alimento en la totalidad de los estómagos. El espectro trófico basado en la
identificación de 283 presas resultó integrado por catorce (14) entidades taxonómicas, todas correspondientes
a la fracción animal (100%). (Tabla 4).
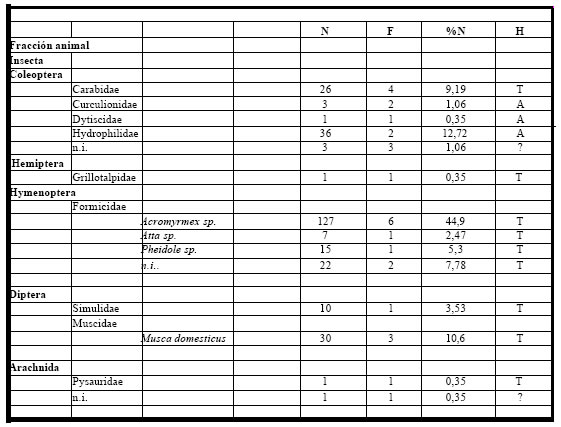
Tabla 4. Espectro trófico de Xolmis coronata. N = nº de organismos; F = frecuencia de captura; % = porcentaje numérico; H = hábitat (A: acuático, T: terrestre); ni = no identificado
Los organismos numéricamente más importantes correspondieron a los Hymenoptera con Formicidae, siendo las especies más destacas Acromyrmex humilis que representó el 45% del espectro, le siguió Pheidole sp. (5%), Atta sp. (3,1%) y otras no identificadas que tuvieron el 8%. Dentro del orden Coleoptera, los Hydrophilidae (no identificados) representaron el 13%, siguiendo los Carabidae terrestres, Curculionidae y Dytiscidae. El tercer orden de insectos con importancia numérica correspondió a los Diptera con Muscidae (Musca domesticus) con el 11%. Los organismos con menor representación fueron los Arachnida (Pysauridae y otros no identificados).
La diversidad (H) por estómago varió entre 0,24 y 1,34, siendo más frecuentes los valores comprendidos en el intervalo de clase de diversidad media (0,51 - 1,00). El valor medio de diversidad trófica fue de 0,66. En tanto que la diversidad trófica acumulada (Hk) fue 1,88. con la suma de las diez muestras la curva tiende a la estabilización en busca del punto t de Magurran (1989), indicando la muestra mínima. (Fig.7)
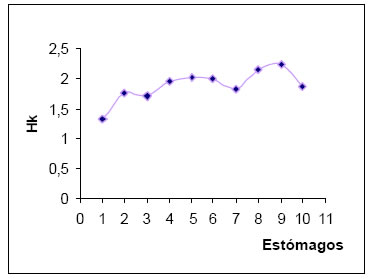
Fig. 7. Curva de diversidad trófica acumulada (HK) de Xolmis coronata.
Los valores de índice de importancia relativa (IRI), que indican la contribución de cada categoría de alimento a la dieta del ave, fueron los siguientes: Hymenoptera = 2460; Coleoptera = 1724; Diptera = 1230; Arachnida = 7 (Fig.8). Estos valores ponen en evidencia que los Hymenoptera con Acromyrmex sp., Pheidole sp. y Atta sp. constituyen la dieta básica, en tanto que los Coleoptera con Hydrophilidae y Carabidae y los Diptera con Musca domesticus, entre los más importantes, conforman la segunda categoría. Los ítems restantes podrían señalarse como categoría accesoria dado que los valores obtenidos son menores.
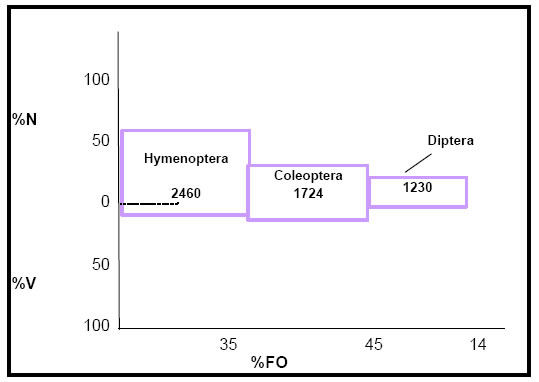
Fig. 8. Índice de importancia relativa (IRI) de Xolmis coronata. %N = porcentaje numérico; %V = porcentaje volumétrico; %FO = frecuencia de ocurrencia.
La amplitud del nicho trófico (AN) fue de 0,72 para otoño, en tanto que 0,74 para invierno. No se contó con datos de las otras estaciones del año, ya que se trata de un residente otoño- invernal. Estos valores, indican que si bien están presentes la mayor parte de las entidades taxonómicas, su presencia se encuentra aminorada, lo que hace que las muestras en estos períodos sean homogéneas. La eficiencia alimentaria (l´e) fue del 97 %. Esto indicaría el ajuste de la especie con el medio. En lo que hace al ritmo diario de actividad alimentaria (IF), calculado entre las 08:00 y las 18:00 se observa una mayor actividad en las primeras horas del día, decayendo en forma manifiesta entre las 14:00 y las 16:00, aumentando nuevamente hacia las 18:00.
El tamaño de las presas osciló entre 3 y 9 mm, siendo más frecuentes las comprendidas en el intervalo de clase (4,5 - >8 ) (93%), y correspondieron básicamente a las distintas formas de Formicidae y Celeoptera, en tanto que las de menor tamaño y menor representación (7%) a Atta sp.
De las ocho unidades de ambiente del valle de inundación, el ave fue registrada en el pastizal donde se registró un valor de 0,48, en tanto que para el monte fue 0,26.
Los antecedentes sobre Xolmis coronata están referidos a aspectos pertenecientes a la nidificación (Meyer de Schauensee, 1982) y breves referencias sobre la biología alimentaria y comportamiento alimentario (Baratini, 1945; Cody, 1975a-b; Haene et al., 1996; Camperi, 1992; Viulleumier, 1994) . Se la señala como solitaria o en pareja. Posada en árboles o postes, desde donde se lanza a capturar insectos (de la Peña, 1977; 1988; 1991), indicándose además que captura en vuelo (Navas, 1982; Marone, 1992) aunque también lo hace correteando por el suelo (Klimatis y Moschione, 1987; Canevari, et al., 1991a-b). La mayoría señala su presencia en montes, campos abiertos y arbolados (Canevari, et al., 1991a-b), también frecuenta orillas de bañados y campos anegadizos (Zapata, 1975). De la Peña (2001) es el único que señala con cierta resolución taxonómica su dieta al indicar la ingestión de mosquitos (Culicidae). Si bien se han hallado numerosos taxa que se corresponden con el uso del hábitat y los patrones alimentarios señalados por los antecedentes; esto justifica la presencia de Formicidae (Acromyrmex humilis, Pheidole sp.; Atta sp.; Carabidae), todas formas terrestres y además, la identificación de formas aéreas como los Muscidae (Musca sp.), sorprende la presencia de una importante contribución de organismos pertenecientes a fauna asociada a la vegetación acuática tales como los Hydrophilidae, Curculionidae y Dytiscidae. Los valores de preferencia de hábitat obtenidos son coincidentes con las observaciones efectuadas y los antecedentes bibliográficos. El valor de alta preferencia por el pastizal debe asociarse para esta especie a la proximidad de la unidad de vegetación acuática, al entender que esto explica su participación trófica en la mencionada GUVA, donde incorpora organismos ligados a la vegetación (fauna del pleuston tales como Dytiscidae e Hydrophilidae), incorporándola al gremio de las aves insectívoras de percha con revoloteo y persecución.
SATRAPA ICTEROPHRYS (SUIRIRÍ AMARILLO)
Todos los estómagos analizados (n = 7), pertenecientes a los períodos 1981-1982-1983-1985-
1990-1991, contuvieron alimento. De la identificación de 91 presas, el espectro trófico resultó representado
por catorce (14) entidades taxonómicas, de las cuales doce (12) correspondieron a la fracción
animal y el resto, (2), a la fracción vegetal. (Tabla 5).
 |
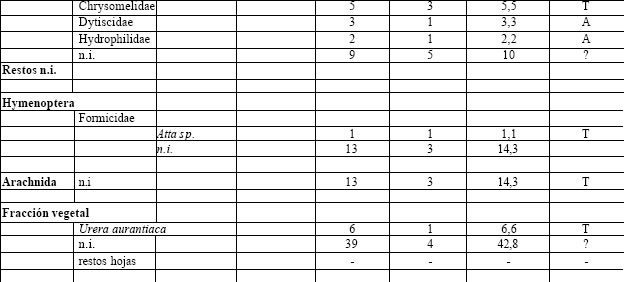 |
Tabla 5. Espectro trófico de Satrapa icterophrys. N = nº de organismos; F = frecuencia de captura; % = porcentaje numérico; H = hábitat (A: acuático, T: terrestre); ni = no identificado
La fracción animal fue la más importante taxonómicamente (51%), del total de las presas. Los alimentos ingeridos corresponden a los Coleoptera, tanto con formas asociadas a la vegetación acuática, como Curculionidae, Hydrophilidae y Dytiscidae, como con formas terrestres, como lo son los Carabidae. Con escasa representación numérica se encontró los Lepidoptera con Noctuide sp. Formicidae con Atta sp. y Arachnida con especies no identificadas. A la fracción vegetal, le correspondió el 49% del total de las ingestas, y estuvieron representadas por Urera aurantiaca, semillas no identificadas y restos de hojas.
La diversidad trófica (H) por estómago varió entre 0,8 y 1,87, siendo el intervalo más frecuente el de diversidad media (0,51 - 1,00). El valor medio de diversidad trófica fue de 1,13.
En tanto que el valor correspondiente a la diversidad trófica acumulada (Hk) fue de 2,68. La curva tiende a la estabilización, lo que permitiría alcanzar el punto t (Magurran, 1989).(Fig.9).
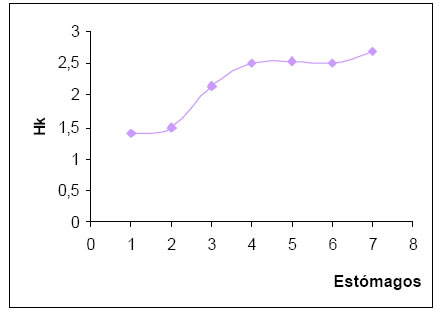
Fig. 9. Diversidad trófica acumulada (Hk) de Satrapa icterophrys
La contribución de cada categoría de alimento a la dieta del ave (IRI)fue la siguiente: Coleoptera = 2812; Lepidoptera y Arachnida = 1365; Semillas =1089; Hymenoptera = 2 (Fig.10).
Los Coleoptera, estuvieron representados por seis especies, constituyendo el alimento más importante, en su mayoría asociados a la vegetación acuática y pertenecientes a la fauna del pleuston, los Lepidoptera, Arachnida y las semillas conformarían la segunda categoría, en tanto que los Hymenoptera con Formicidae, podrían señalarse como una ingesta accesoria dado que los valores son marcadamente menores.
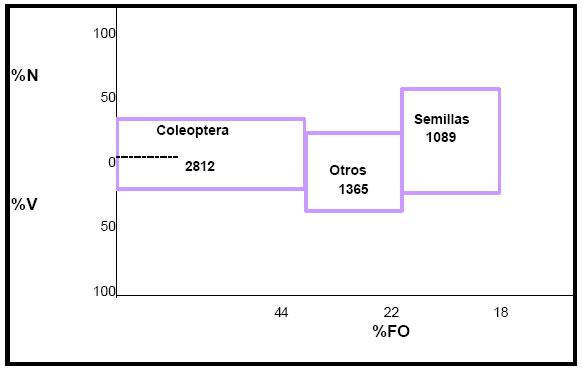
Fig. 10. Índice de importancia relativa (IRI) de Satrapa icterophrys. %N = porcentaje numérico; %V = porcentaje volumétrico; %FO = frecuencia de ocurrencia.
La amplitud del nicho trófico fue de 0,7 para primavera y otoño, mientras que para verano e invierno resultó ser 0,6. Estos valores registrados, indican que las muestras son homogéneas y uniformes para las estaciones. La eficiencia alimentaria (l´e), resultó ser del 97%, el cual revela el ajuste de la especie con el medio. El ritmo circadiano de actividad alimentaria (IF), permitió visualizar una mayor actividad a entre las 12:00 y las 16:00 horas.
El tamaño de las presas osciló entre 2 y 28 mm, con una mayor ocurrencia por los organismos de mayor talla (4,5 - >8), y que correspondieron a los Lepidoptera, Hydrophilidae, Chrysomelidae, Arachnida no identificada y Carabidae, entre los más importantes; los de menor talla estuvieron representados por Formicidae con Atta sp., por semillas no identificadas y Urera aurantiaca.
Los valores obtenidos en la preferencia de hábitat (Pi), solamente fueron para la unidad ambiente de monte, donde el ave fue registrada y que resultó ser de 0,3.
Nores e Izurieta (1982), hacen una descripción sobre su distribución, con respecto a su alimentación los antecedentes son escasos o nulos. Este trabajo hace un aporte muy importante sobre su dieta, basada fundamentalmente en coleópteros, tanto terrestres como aquellos asociados a la vegetación acuática, además de restos de hojas y semillas de Urera aurantiaca, incluyéndolo, siguiendo en parte el criterio de Kirkconnel et al (1992), en el gremio de los básicamente insectívoros de percha y explorador de tallos, hojas y troncos.
TYRANNUS MELANCHOLICUS (SUIRIRÍ GRANDE)
En todos los estómagos analizados (n = 6), pertenecientes al período 1990-1991, se observó la
presencia de alimento. El espectro trófico con la identificación de 103 presas, resultó integrado por
trece (13) entidades taxonómicas, de las cuales nueve (9) resultaron pertenecientes a la fracción animal
y el resto, cuatro (4), a la fracción vegetal, (Tabla 6).
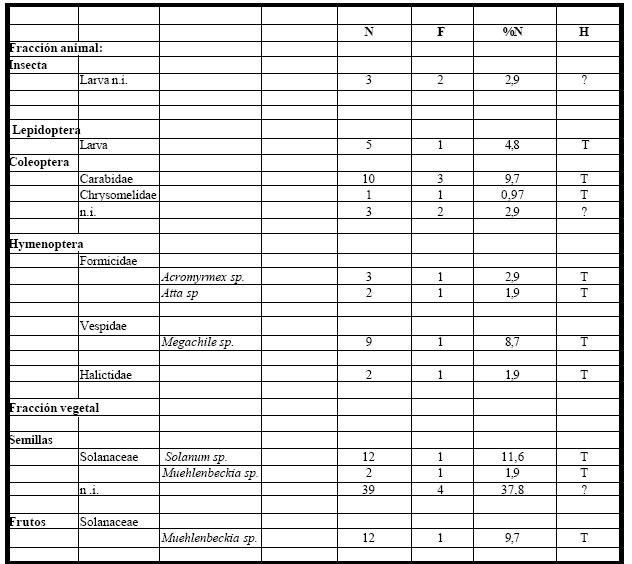
Tabla 6. Espectro trófico de Tyrannus melancholicus. N = nº de organismos; F = frecuencia de captura; % = porcentaje numérico; H = hábitat (A: acuático, T: terrestre); ni = no identificado
De la observación del espectro trófico, se puede señalar que la fracción animal fue la más importante taxonómicamente, correspondiendo el 37% del total de las ingestas, y estuvieron representadas por los Coleoptera con formas terrestres como Carabidae y Chrysomelidae, por los Hymenoptera con Formicidae, (Atta sp.y Acromyrmex sp.) por Vespidae (Megachile sp.) Halictidae, y por los Lepidoptera. La fracción vegetal, si bien fue importante numéricamente, le correspondió el 63% del total de las ingestas, y estuvo representada por semillas de Solanum sp. y Muehlenbeckia sp.
La diversidad trófica (H) por estómago, osciló entre 0,62 y 1,31, dándose la mayor frecuencia en el intervalo de alta diversidad (1,01 - >2,00); en tanto que, la diversidad media fue de 0,99. La diversidad trófica acumulada (Hk) tuvo un valor de 2,79. Con la suma de los seis muestras, la curva tiene un crecimiento exponencial, no alcanzando la asíntota (P.t, Magurran, 1989), (Fig.11).
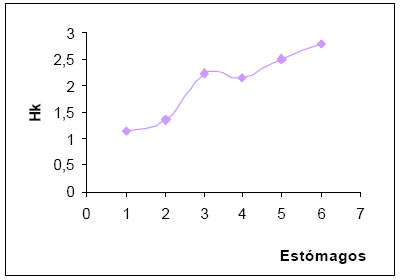
Fig. 11. Diversidad trófica acumulada (Hk) de Tyrannus melancholicus basada en el número de estómagos.
Por medio de la aplicación del índice de importancia relativa (IRI), a la contribución de cada categoría de alimento, se obtuvieron los siguientes valores: Coleoptera y Lepidoptera =3324; Hymenoptera (Formicidae y Vespidae) =546; Semillas: 3384 (Fig.12).
Las semillas integradas por Solanum sp., Muehlenbeckia sp, y las no identificadas, resultaron los organismos de mayor importancia en la dieta del ave. Los restantes grupos podrían señalarse como categorías secundarias dado que sus valores son menores.
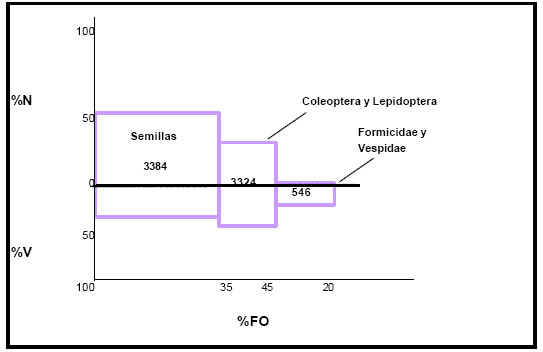
Fig. 12. Índice de importancia relativa (IRI) de Tyrannus melancholicus. %N = porcentaje numérico; %V = porcentaje volumétrico; %FO = frecuencia de ocurrencia.
En lo que respecta a la amplitud del nicho trófico (AN) los valores obtenidos fueron los siguientes: 0,77 para verano; 0,36 para invierno y 0,81 para primavera. No se poseyeron datos de la estación de otoño, debido a que no hubo capturas. El valor más bajo correspondió al invierno, donde la muestra está maximizada por la presencia de semillas no identificadas. Los valores altos registrados del verano y de la primavera, indican que si bien están presentes la mayoría de las taxas, las muestras son más homogéneas. El valor de la eficiencia alimentaria (l´e) fue del 97%, lo que indicaría un ajuste de la especie con el medio. El ritmo diario de actividad alimentaria (IF) calculado entre las 08:00 y las 18:00 muestra una mayor actividad en las primeras horas del día, particularmente entre las 08:00 y las 14:00, decayendo en forma manifiesta desde esta hora hasta las18:00.
El tamaño de las presas varió entre 2 y >8 mm, siendo más frecuentes las ingestas comprendidas en el intervalo de clase (4,5 - >8), y que correspondieron a formas terrestres como Carabidae, Formicidae (Acromyrmex sp., Atta sp.) y larvas de Lepidoptera, entre los más importantes, a los restantes intervalos les correspondieron las semillas no identificadas las de Solanum sp, Hymenopteray Carabidae.
El ave fue registrada en la unidad ambiental de pastizal y monte, donde los valores de preferencia de hábitat fueron 0,16 y 0,78 respectivamente.
Los antecedentes, solamente están referidos a aspectos que hacen a su distribución geográfica, descripción y dinámica temporal (Capurro y Bucher, 1986; de la Peña, 1993; Soave, et al, 1999). En la bibliografía, Marelli (1919) y Harrison (1978) indican una dieta compuesta por mosquitos, coleópteros, dípteros, sustancias vegetales y algunos frutos. Siguiendo el criterio de Kirkconnell et al (1992) se lo incluye en el gremio de los básicamente insectívoros de percha. Este aporte constituye el único que alcanza una detallada identificación de algunos ítemes alimentarios.
MACHETORNIS RIXOSUS (PICABUEY)
Todos los estómagos analizados (n=6), correspondientes al período 1990-1991, contuvieron
alimento. En el espectro trófico se identificaron 65 presas, las que estuvieron representadas por trece
(13) entidades taxonómicas, pertenecientes todas a la fracción animal (100%). (Tabla 7)
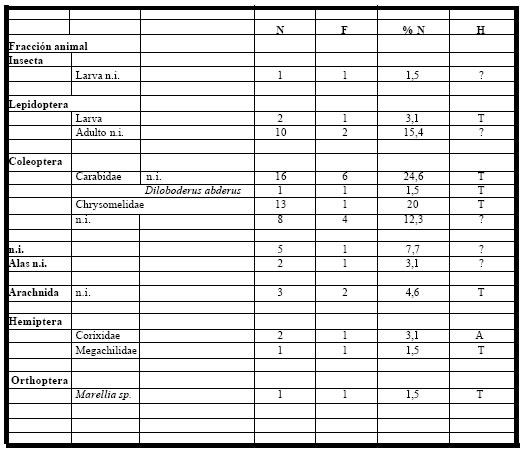
Tabla 7. Espectro trófico de Machetornis rixosus. N = nº de organismos; F = frecuencia de captura; % = porcentaje numérico; H = hábitat (A: acuático, T: terrestre); ni = no identificado.
La fracción animal, compuesta en su mayor parte por organismos terrestres, fue la más importante, ya que representó el 100% del total de las ingestas. Estuvo integrada por los Coleoptera (Chrysomelidae, Carabidae), Lepidoptera, Arachnida y Hemiptera (Corixidae), entre los más característicos, en menor proporción se encontraron los Orthoptera (Marellia sp.), larvas de insectos no identificadas y de Lepidoptera.
La diversidad trófica (H) por estómago osciló entre 0,86 y 2,3 siendo más frecuente el intervalo de alta diversidad (1,01 - >2,00), en tanto que la diversidad media tuvo un valor de 0,67. La diversidad trófica acumulada (Hk) fue de 1,64. La suma de las muestras al azar, permite observar que la curva tiende a la estabilización, con la que se alcanzaría el punto t (Magurran, op.cit.). (Fig.13)
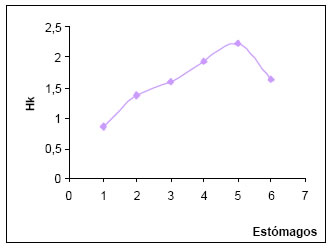
Fig. 13. Diversidad trófica acumulada (Hk) de Machetornis rixosus.
La contribución de cada categoría de alimento obtenida por la aplicación del índice de importancia relativa (IRI), arrojó los siguientes valores: Coleoptera = 7548; Otros (Arachnida, Lepidoptera, Orthoptera, Hemiptera ) = 2882 (Fig.14).
Estos valores indican el régimen alimenticio del ave, y destacan la importancia predominante de los Coleoptera; las entidades taxonómicas restantes, por sus valores menores en número, volumen y frecuencia de ocurrencia, son considerados categorías secundarias de alimento.
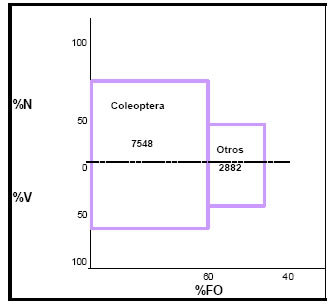
Fig. 14. Índice de importancia relativa (IRI) de Machetornis rixosus. %N = porcentaje numérico; %V = porcentaje volumétrico; %FO = frecuencia de ocurrencia.
La amplitud del nicho trófico (AN) tuvo un valor de 0,6 para otoño, 0,7 para invierno, 0,8 para primavera y 0,7 para verano. Los altos valores registrados indican, que se mantienen uniforme durante los cuatro períodos con muestras homogéneas. La eficiencia alimentaria (l´e), alcanzó un valor del 95%. En lo que hace al ritmo diario de actividad alimentaria (IF), calculado entre las 08:00 y las 12:00, se observó una mayor actividad en el lapso estudiado, no contando con datos de la tarde, porque no hubo capturas.
El tamaño de las presas varió entre 2,5 y >15 mm, siendo más frecuentes las ingestas comprendidas en el intervalo (4,5 - >8), representadas por los Coleoptera (Carabidae, Chrysomelidae), Arachnida, restos de insectos no identificados, Orthoptera (Marellia sp.), Chrysomelidae y por larvas y adultos de Lepidoptera; las de menor tamaño por algunos Carabidae.
Los valores obtenidos para la preferencia de hábitat (Pi), fueron 0,22 para monte y 0,66 para la unidad ambiental de pastizal, que fueron los ambientes donde el ave fue registrada.
Los registros bibliográficos, hacen una descripción de sus características y dinámica temporal (Capurro y Bucher, 1986; Biolé y Baliño, 1985), en cuanto a su alimentación, Marelli (1919) señala una dieta basada en coleópteros y fragmentos de pasto, indicando los ítemes alimentarios con un bajo nivel de precisión. Este estudio hace un primer aporte para el área sobre su dieta, identificando y cuantificando su espectro trófico e incorporándolo en el gremio de los que forrajean en el suelo y sobre el ganado.
TYRANNUS SAVANA (TIJERETA)
Todos los estómagos analizados (n =4), correspondientes al período 1990- 1991, contuvieron
alimento. El espectro trófico basado en la identificación de 34 ítemes alimentarios, resultó compuesto
por diez (10) entidades taxonómicas, de las cuales, nueve correspondieron a la fracción animal, y
una (1) a la fracción vegetal. (Tabla 8)
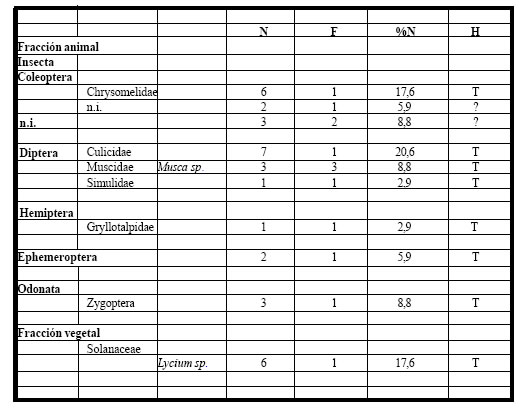
Tabla 8. Espectro trófico de Tyrannus savana. N = nº de organismos; F = frecuencia de captura; % = porcentaje numérico; H = hábitat (A: acuático, T: terrestre); ni = no identificado
De las ingestas halladas en los estómagos, el 90% correspondió a la fracción animal, la cual estuvo representada por formas terrestres de Coleoptera (Chrysomelidae, Gryllotalpidae); Diptera (Muscidae con Musca sp., Simulidae, Culicidae); Ephemeroptera y Odonata; a la fracción vegetal le correspondió el 10% del total y estuvo integrada por semillas de Solanaceae (Lycium sp.).
La diversidad trófica (H) por estómago osciló entre 0,85 y 1,04, siendo más frecuentes los comprendidos en el intervalo de diversidad media (0,51- 1,00). La diversidad media, alcanzó un valor de 0,95.
Mientras que la diversidad trófica acumulada (Hk) fue de 2,55. La sumatoria de las muestras al azar, muestran un manifiesto crecimiento exponencial por lo que no se alcanza la asíntota. (Fig.15).
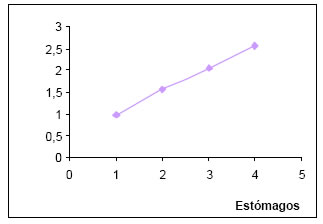
Fig. 15. Diversidad trófica acumulada (Hk) de Tyrannus savana.
Por medio de la aplicación del índice de importancia relativa (IRI) a la contribución de cada categoría de alimento a la dieta del ave, se obtuvieron los siguientes valores: Diptera y otros = 2421; Coloptera = 1772; Semillas = 147 (Fig.16)
Estos valores proporcionan una idea del régimen alimenticio del ave, y destacan la importancia de los Diptera como alimento principal. Los Coleoptera constituyen una categoría secundaria, en tanto que a la fracción vegetal se la incluye dentro de la categoría de alimentos accesorios.
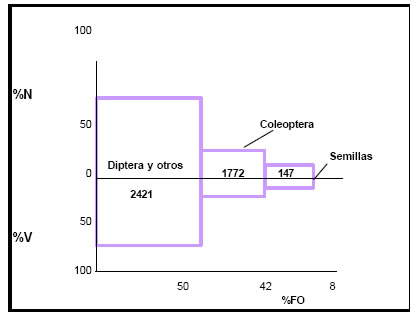
Fig. 16. Índice de importancia relativa (IRI) de Tyrannus savana. %N = porcentaje numérico; %V = porcentaje volumétrico; %FO = frecuencia de ocurrencia.
La amplitud del nicho trófico para primavera, fue 0,75 y para verano, 0,74. Los cálculos para otoño e invierno no corresponden pues se trata de un residente primavero- estival. Estos valores, indican que para ambos períodos las muestras son homogéneas. La eficiencia alimentaria fue de 96%. Este valor indica el ajuste de la especie con el medio. En lo que hace al ritmo diario de actividad alimentaria (IF), calculado entre las 08:00 y las 14:00, se visualizó una mayor actividad en las primeras horas del día, particularmente entre las 08:00 y las 11:00, a partir de allí fue decayendo.
El tamaño de las presas, varió entre 1,5 y 30mm, siendo las ingestas más frecuentes las comprendidas en los intervalos de clase (0 -2) y (4,5 - >8) y que correspondieron a Coleoptera (Chrysomelidae, Gryllotalpidae), insectos no identificados, Simulidae, Culicidae, y a las semillas de Solanaceae (Lycium sp.). En lo que respecta a la preferencia de hábitat (Pi), el valor registrado fue 0,3 para el bosque en galería.
Los antecedentes registrados se basan generalmente en descripciones, dinámica poblacional, distribución, hábitat, densidad y su forma de alimentación, haciendo también hincapié en su migración (Marelli, 1919, Lucero y Alabarce, 1980; Nores e Izurieta, 1981; Biolé y Baliño, 1985; Capurro y Butcher, 1986; Canevari y Narosky,1995; Barbarskas, et al 1996; de la Peña y Rumboll 1998; Soave, et al, 1999;). Con respecto al comportamiento alimentario los antecedentes son muy escasos, solamente se señala que habita en lugares abiertos donde se posa generalmente en alambrados o cables de luz, para lanzarse a capturar insectos, abejas o coleópteros, que han sido hallados en el contenido estomacal de algunas de estas aves (Harrison,1978; Marone, 1992; Canevari y Narosky, 1995); incorporándolo en el gremio de los básicamente insectívoros de percha con capturas en vuelo (Kirkconnell et al, 1992).
CORYPHOSPINGUS CUCULLATUS (BRASITA DE FUEGO)
En todos los estómagos analizados (n =5), pertenecientes al período 1990-1991, se observó la
presencia de alimento.
El espectro trófico basado en 138 ítems alimentarios, estuvo representado por once (11) entidades taxonómicas, de las cuales, seis (6) correspondieron a la fracción animal, y las cinco (5) restantes a la fracción vegetal. (Tabla 9)
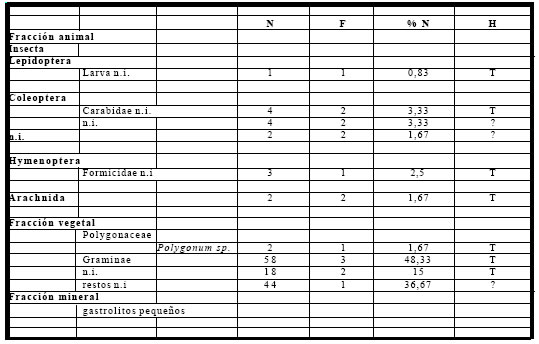
Tabla 9. Espectro trófico de Coryphospingus cucullatus. N = nº de organismos; F = frecuencia de captura; % = porcentaje numérico; H = hábitat (A: acuático, T: terrestre); ni = no identificado
La fracción vegetal fue numéricamente la más importante, representando el el 88% del total de las ingestas. Las semillas ingeridas estuvieron representadas por especies arbustivas y herbáceas como Polygonum sp., Graminae y por semillas no identificadas. La fracción animal, si bien fue menos importante numéricamente, ya que representó el 12% del total, taxonómicamente fue la más abundante, y estuvo compuesta por Coleoptera (Carabidae), insectos no identificados, Formicidae, Arachnida y larvas de Lepidoptera, también fueron encontrados numerosos gastrolitos pequeños.
Los valores de diversidad trófica (H) por estómago, oscilaron entre 0,52 y 1,14, siendo más frecuentes los comprendidos en el intervalo de diversidad media (0,51 - 1,00). La diversidad media fue 0,78. La diversidad trófica acumulada (Hk) tuvo un valor de1,94. La sumatoria de las muestras al azar muestran un crecimiento exponencial por lo que no se alcanza la estabilización (P.t, Magurran,1989). (Fig.17)
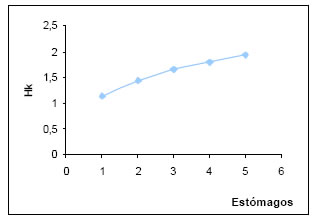
Fig. 17. Diversidad trófica acumulada (HK) de Coryphospingus cucullatus.
La contribución de cada categoría de alimento a la dieta de la especie obtenida por la aplicación del índice de importancia relativa (IRI), arrojó los siguientes valores: Semillas = 5991; Coleoptera = 1790; Otros (Lepidoptera, Arachnida e Hymenoptera) = 437 (Fig.18)
Valores que dan una visión de la dieta del ave, constituyendo las semillas el alimento principal de esta especie, los Coleoptera, la segunda categoría de alimento, en tanto que Lepidoptera, Arachnida e Hymenoptera, alimentos accesorios.
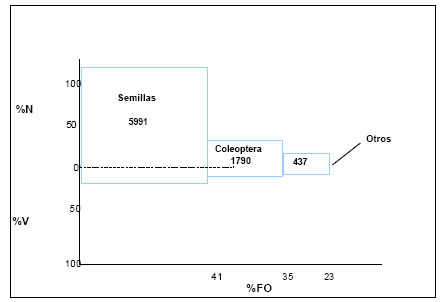
Fig. 18. Índice de importancia relativa (IRI) de Coryphospingus cucullatus. %N = porcentaje numérico; %V = porcentaje volumétrico; %FO = frecuencia de ocurrencia.
Los valores pertenecientes a la amplitud del nicho trófico (AN), fueron los siguientes: 0,7 para primavera; 0,4 para otoño e invierno, no se contó con datos de verano ya que no hubo capturas en esa estación. Los valores bajos de estas dos últimas estaciones, se debió a que la muestra estuvo maximizada por la presencia de gramíneas en otoño y de insectos no identificados en invierno; el valor alto registrado en primavera indica que la muestra fue más homogénea en dicha estación.
La eficiencia alimentaria (l´e) fue del 97%, este valor estaría indicando que el ave se ajusta al medio. Por medio del ritmo diario de actividad alimentaria (IF), calculado entre las 08:00 y las 16:00, se visualizó una mayor actividad al mediodía aumentando hasta las primeras horas de la tarde.
El tamaño de las presas estuvo comprendido entre 1 y 5 mm, siendo más frecuentes las del intervalo (0 - 2), que correspondieron a la fracción vegetal, integrada por semillas de Polygonum sp., a las Graminae y a las semillas no identificadas. Las ingestas de mayor tamaño estuvo representada por Coleoptera (Carabidae), Arachnida, Formicidae, insectos no identificados y larvas de Lepidoptera.
Respecto a la preferencia de hábitat (Pi), el ave fue registrada en la unidad ambiental de monte, donde se obtuvo un valor de 0,3.
Numerosos antecedentes bibliográficos están referidos a su descripción y distribución geográfica (de la Peña, 1997a-b, 1999). En cuanto a su alimentación la mayoría se basa en su biología alimentaria y comportamiento alimentario, señalando que se los encuentra recorriendo partes bajas de la vegetación arbustiva densa y los pajonales, bajando al suelo en busca de semillas, pastos, insectos y frutos pequeños para alimentarse (Navas, 1982; Canevari y Narosky, 1995; Canevari et al, 1991a-b). Ordano et al (1999), indica una dieta compuesta por Hydrophilidae (Helochares sp.), Curculionidae y Hemiptera. Se lo ubica en el gremio de los básicamente insectívoros de suelo y follaje con picoteo y espigueo. Este estudio constituye un primer aporte para el valle de inundación del Paraná.
ZONOTRICHIA CAPENSIS (CHINGOLO)
Todos los estómagos analizados (n =8), correspondientes al período 1990-1991, contuvieron
alimentos. El espectro trófico basado en la identificación de 148 presas, resultó integrado por trece
(13) entidades taxonómicas, once (11) pertenecientes a la fracción animal, y las dos (2) restantes a la
fracción vegetal. (Tabla 10)
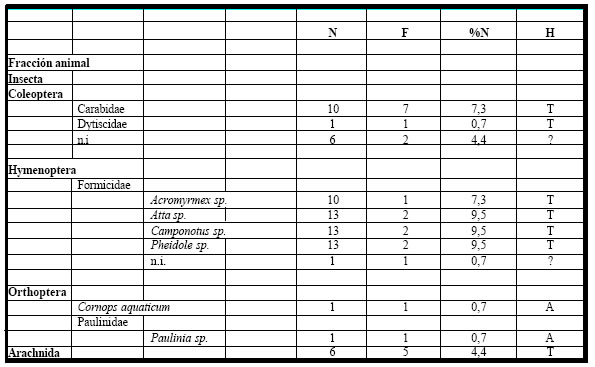
Tabla 10. Espectro trófico de Zonotrichia capensis. N = nº de organismos; F = frecuencia de captura; % = porcentaje numérico; H = hábitat (A: acuático, T: terrestre); ni = no identificado
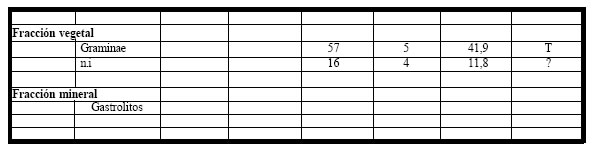
Tabla 10. Espectro trófico de Zonotrichia capensis. N = nº de organismos; F = frecuencia de captura; % = porcentaje numérico; H = hábitat (A: acuático, T: terrestre); ni = no identificado
La fracción animal fue numérica como taxonómicamente la más importante, representando el 51% del total de las ingestas, la integraron mayoritariamente formas terrestres y acuáticas (Carabidae, Dytiscidae, Formicidae con Acromyrmex sp., Pheidole, Camponotus sp. Atta sp, Orthoptera con Cornops aquaticum, Paulinia sp. y Arachnida). La fracción vegetal fue menos numerosa con un 49% del total y estuvo representada por semillas de Graminae y algunas formas no identificadas. También fueron encontrados como fracción mineral numerosos gastrolitos pequeños.
La diversidad trófica (H) por estómago varió entre 0,4 y 1,43, siendo el intervalo más frecuente el de diversidad media (0,51 - 1,00). Siendo la diversidad media de 0,85. La diversidad trófica acumulada (Hk) fue de 2,89. La suma de las 8 muestras al azar muestra una leve tendencia a la estabilización, que permitiría alcanzar el punto t (Magurran, op.cit.), (Fig.19).
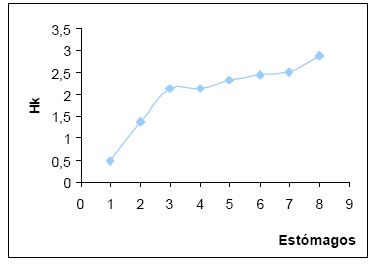
Fig. 19. Diversidad trófica acumulada (Hk) de Zonotrichia capensis.
Por medio de la aplicación del índice de importancia relativa (IRI) a la contribución de cada categoría de alimento a la dieta de la especie, se obtuvieron los siguientes valores: Semillas = 1660; Coleoptera = 1651; Orthoptera y Arachnida = 1121; Hymenoptera (Formicidae) = 632 (Fig.20). Estos valores ponen en evidencia que las semillas y los Coleoptera constituyen la dieta básica del ave, los Arachnida y Orthoptera podrían considerarse como categorías secundaria de alimento, en tanto que los Formicidae por sus valores menores, conformarían los alimentos accesorios.
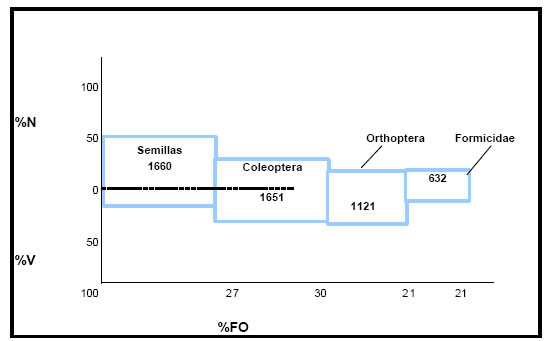
Fig. 20. Índice de importancia relativa (IRI) de Zonotrichia capensis. %N = porcentaje numérico; %V = porcentaje volumétrico; %FO = frecuencia de ocurrencia.
La amplitud del nicho trófico (AN) para las distintas estaciones del año, tuvo los siguientes valores: 0,8 para primavera; 0,6 para verano e invierno y 0,7 para otoño. Estos valores indican que las muestras fueron homogéneas para todas las estaciones del año. La eficiencia alimentaria (l´e) fue del 95%. En lo que respecta al ritmo diario de actividad alimentaria (IF), presentó un patrón que describe un pico de actividad entre las 10:05 y las 12:00 horas, decayendo marcadamente en las primeras horas de la tarde (hasta las 16:00 horas).
El tamaño de las presas osciló entre 2 y 25 mm, con una mayor ocurrencia por los organismos de menor talla, y que correspondió al intervalo de clase (0 - 2). Dicho intervalo estuvo integrado por organismos pertenecientes a los Coleoptera (Carabidae, Dytiscidae), Formicidae (Atta sp.), Arachnida, a las semillas no identificadas y las Graminae. Los organismos de mayor talla estuvieron representados por Formicidae (Acromyrmex sp., Pheidole sp., Camponotus sp,) y Ortoptera (Paulinia sp.), entre los más importantes.
En lo referente a la preferencia de hábitat (Pi), el ave fue registrada en la unidad ambiental de monte, donde su valor fue 0,3.
En general los antecedentes están referidos a aspectos que hacen a su distribución geográfica, descripción, densidad poblacional, dinámica temporal, vocalizaciones (Lucero y Alabarce,1980; Contreras et al., 1980; Nores e Izurieta, 1981; Harrison, 1978; Biolé y Baliño, 1985; Zapata y Novatti, 1995; Chikilián, et al., 1993; de la Peña 1993, 1994; Tubaro, et al., 1996a-b, 1997; Canevari y Narosky, 1995; Camperi y Darrieu, 2001; Capurro y Bucher, 1986; Soave, et al., 1999).
En lo referente a la dieta, algunos antecedentes se limitan a indicar los ítemes alimentarios con un bajo nivel de precisión en lo que hace a la resolución taxonómica. Marelli (1919) señala una dieta básicamente granívora, Grigera (1976) señala también un aporte importante de granos (Polygonum sp. y Plantago sp.), como también la incorporación de insectos entre los que señala los Chrysomelidae, Diptera (larvas y adultos) y restos de gastrolitos. Ochoa de Masramón (1979) menciona solamente que consume granos en coincidencia con Capurro y Bucher (1982), que lo señalan como granívoro. Ordano (1999) indica una dieta compuesta por Orthoptera, Coleoptera, Dytiscidae, Curculionidae, Scarabeidae, Hymenoptera (Camponotus), Formicidae (Pheidole sp., Acromyrmex sp.) y semillas; mientras que de la Peña (2001) incluye frutos de mora blanca (Morus alba) y semillas de Chenopodium sp. Siguiendo el criterio de Kirkconnel (1992) se lo incluye en el gremio de los básicamente insectívoros de suelo y follaje con picoteo y espigueo.
Este trabajo aporta los primeros datos cuantificados sobre la dieta para el área.
ICTERUS CAYENENSIS (BOYERITO)
En todos los estómagos analizados (n = 6), pertenecientes a los períodos 1981-1982-1983-1985,
se determinó la presencia de alimento. El espectro trófico constituido por 71 presas, estuvo representado
por once (11) entidades taxonómicas, de los cuales siete (7) correspondieron a la fracción animal
y los cuatro (4) restantes a la fracción vegetal. (Tabla 11).
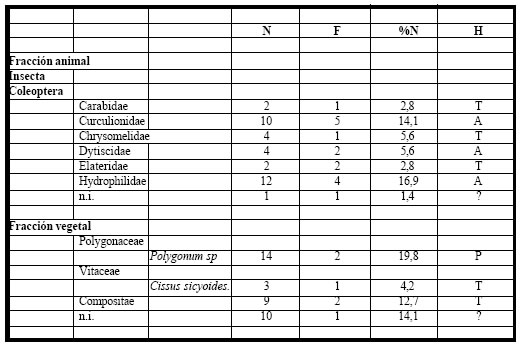
Tabla 11. Espectro trófico de Icterus cayenensis. N = nº de organismos; F = frecuencia de captura; % = porcentaje numérico; H = hábitat (A: acuático, T: terrestre); ni = no identificado
La fracción vegetal fue numéricamente la más importante, correspondiendo el 51% del total de los alimentos ingeridos, y el cual estuvo integrado por semillas de Polygonum sp., Cissus sicyoides por Compositae y algunas especies no identificadas. La fracción animal fue más importante taxonómicamente y le correspondió el 49% del total, estuvo integrada mayoritariamente por formas asociadas a la vegetación acuática e integrantes de la fauna del pleuston, como los Hydrophilidae, Curculionidae y Dytiscidae, en tanto que las formas terrestres por Carabidae, Chrysomelidae, Elateridae. Otros insectos con escasa representación numérica fueron los no identificados.
La diversidad trófica (H) por estómago, osciló entre 0,31 y 1,34. Siendo más frecuentes los comprendidos en el intervalo de alta diversidad (1,01 - >2,00).La diversidad trófica acumulada (Hk) alcanzó un valor de 1,91. Con la suma al azar de las seis muestras, la curva tiende a la estabilización, lo que permitiría alcanzar el punto t (Magurran, op.cit.), (Fig.21).
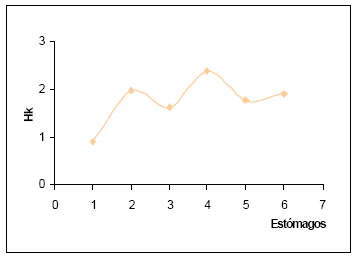
Fig. 21. Diversidad trófica acumulada (Hk) de Icterus cayenensis basada en el número de estómagos.
Por medio de la aplicación del índice de importancia relativa (IRI) a la contribución de cada categoría de alimento a la dieta del ave, se obtuvieron los siguientes valores: Coleoptera = 10137; Semillas = 1652 (Fig.22). Siendo la fracción animal integrada por los Coleoptera el alimento principal, y por lo tanto los que aportan mayor energía a esta especie. Los ítemes restantes, integrados por la fracción vegetal podrían señalarse como categorías secundarias de alimento por su valor bajo.
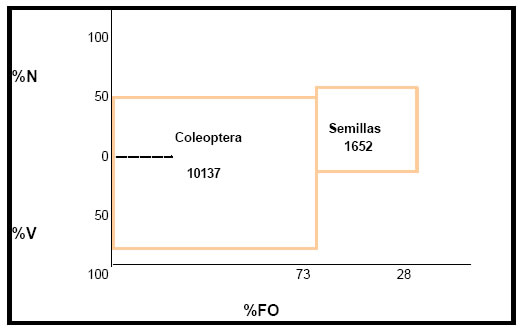
Fig. 22. Índice de importancia relativa (IRI) de Icterus cayenensis. %N = porcentaje numérico; %V = porcentaje volumétrico; %FO = frecuencia de ocurrencia.
La amplitud del nicho trófico arrojó los siguientes valores: 0,5 para otoño, 0,8 para invierno, 0,7 para primavera y verano. Los valores altos de invierno, primavera y verano, indican una muestra homogénea, en contraste con estos, el valor bajo de otoño, se debió al registro de un íteme importante y que correspondió a las semillas de Polygonum sp.
La eficiencia alimentaria alcanzó un valor de 96%, y el cual estaría indicando el ajuste de la especie con el medio. Respecto al ritmo diario de actividad alimentaria (IF), se visualizó una mayor actividad en las primeras horas del día, particularmente entre las 08:00 y las 10:00, decayendo hacia el mediodía, y luego aumentando levemente hasta las 16:00 horas.
El tamaño de las presas osciló entre 1,5 y 9 mm, siendo más frecuentes las ingestas comprendidas entre (4,5 - >8) y que correspondieron a Chrysomelidae, Hydrophilidae, Curculionidae, semillas de Cissus sicyoides y no identificadas, Elateridae y Dytiscidae; las de menor talla estuvieron representadas por algunos Curculionidae, Carabidae terrestres, semillas de Polygonum sp. y Compositae.
Los valores obtenidos en la preferencia de hábitat (Pi) fueron de 1,01 para el bosque en galería y de 0,17 para la vegetación acuática.
La mayor parte de la información referida a esta especie se basa únicamente a su distribución geográfica, variación estacional y dinámica poblacional (Camperi, 1989; Capurro y Bucher, 1986; Biolé y Baliño, 1985; Camperi y Darrieu, 2001); en referencia a la biología alimentaria, este trabajo es un aporte importante debido a que son prácticamente nulos los antecedentes que cuantifican e identifiquen la composición de su espectro trófico. Se lo incorpora al gremio de los básicamente insectívoro, explorador de tallos, troncos y hojas.
CACICUS SOLITARIUS (BOYERO NEGRO)
Todos los estómagos analizados (n =8), pertenecientes a los períodos 1980-1981-1982-1983-
1985, contuvieron alimento. El espectro trófico basado en la identificación de 271 presas, resultó
integrado por dieciséis (16) entidades taxonómicas, once (11) pertenecientes a la fracción animal; las
cinco (5) restantes, a la fracción vegetal. (Tabla 12)
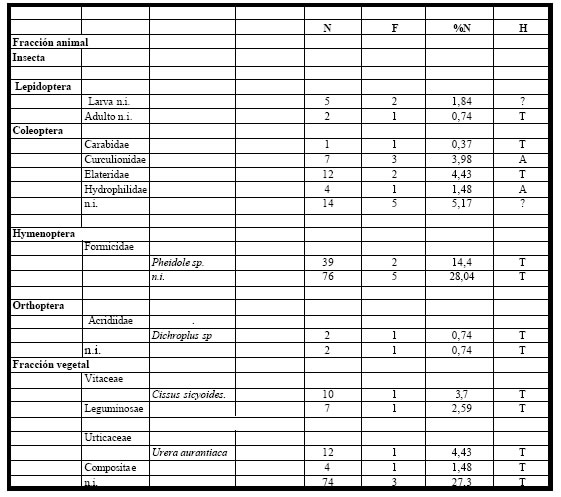
Tabla 12. Espectro trófico de Cacicus solitarius. N = nº de organismos; F = frecuencia de captura; % = porcentaje numérico; H = hábitat (A: acuático, T: terrestre, P: palustre)); ni = no identificado
Del espectro trófico se pudo observar que la fracción animal fue numérica y taxonómicamente más abundante (69%); entre los organismos con mayor contribución numérica fueron los Hymenoptera con Formicidae (Pheidole sp.), siguiéndole los Coleoptera (Carabidae, Elateridae) y algunas formas asociadas a la vegetación acuática y pertenecientes a la fauna del pleuston como lo son los Hydrophilidae y Curculionidae; también estuvieron representados los Orthoptera (Dichroplus sp.) y larvas de Lepidoptera. El 31% restante correspondió a la fracción vegetal, y estuvo representada por semillas de Compositae, Leguminosae, no identificadas, Cissus sicyoides y Urera aurantiaca.
El valor de la diversidad trófica (H) osciló por estómago entre 0,52 y 1,62 , siendo más frecuentes los comprendidos en el intervalo de alta diversidad (1,01 - >2,00). La diversidad media fue de 1,13.
El valor de la diversidad trófica acumulada (Hk) fue de 2,49, habiéndose alcanzado la tendencia a la asíntota que permitiría lograr el punto t (Magurran op.cit.), (Fig.23).
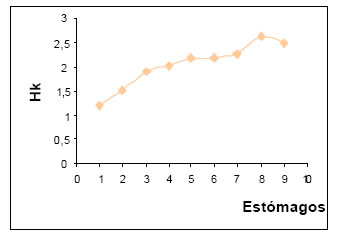
Fig. 23. Diversidad trófica acumulada (Hk) de Cacicus solitarius.
Los valores del índice de importancia relativa (IRI), que indican la contribución de cada categoría de alimento a la dieta del ave, fueron los siguientes: Coleoptera = 1902; Semillas = 1456; Hymenoptera = 985; Orthoptera = 231; Lepidoptera = 82 (Fig.24). Estos valores permiten tener una visión del régimen alimenticio del ave, y en la que los Coleoptera y las semillas constituyen las categorías básicas, en tanto que los Hymenoptera (Formicidae) y los Orthoptera las categorías secundarias, siendo ingestas accesorias los Lepidoptera.
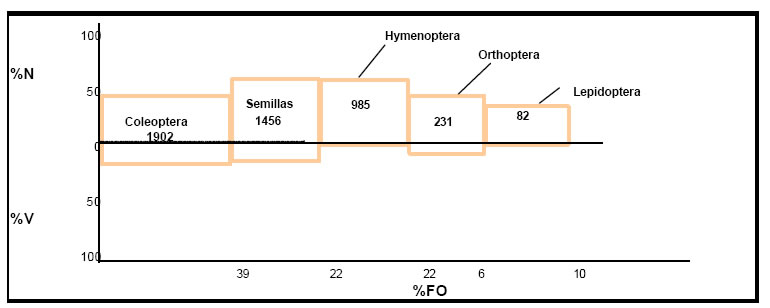
Fig. 24. Índice de importancia relativa (IRI) de Cacicus solitarius. %N = porcentaje numérico; %V = porcentaje volumétrico; %FO = frecuencia de ocurrencia.
La amplitud del nicho trófico (AN) fue 0.6 para otoño, 0.7 para invierno y verano; en tanto que para primavera no se contó con datos. Estos valores indicarían que las muestras se mantienen homogéneas en las tres estaciones. La eficiencia alimentaria (l´e) fue del 96,6%, valor que indicaría el ajuste de la especie con el medio. En lo referente al ritmo circadiano de actividad alimentaria se visualizó una mayor actividad en las primeras horas del día, particularmente entre las 08:00 y 10:00, decayendo en forma manifiesta entre el mediodía y las 16:00.
El tamaño de las presas osciló entre 2 y 70 mm, siendo más frecuentes las ingestas comprendidas en el intervalo (4,5 - > 8) y que correspondieron a los Formicidae (Pheidole sp.), Coleoptera con Elateridae , Hydrophilidae y larvas de Lepidoptera, semillas de Cissus sicyoides, de Leguminosae y otras no identificadas, Orthoptera (Dichroplus sp.), Lepidoptera y Carabidae. Los de menor talla correspondieron a algunos insectos como los Curculionidae y a las semillas de Urera aurantiaca.
El valor obtenido en la preferencia de hábitat (Pi), fue de 0,3 solamente para la unidad ambiental de bosque en galería, donde el ave fue registrada.
En general la mayoría de los antecedentes están referidos a su identificación, distribución geográfica, nidificación y hospedante, siendo escasos aquellos que se refieren a su biología alimentaria y que describen solamente los grandes taxa que componen su espectro sin detalle de resolución taxonómica ni cuantificación (Baratini, 1945; Harrison, 1978; Nores e Izurieta,1981; Contreras, 1983; Biole y Baliño, 1985; Beltzer, 1986; de la Peña, 1987, 1994, 1997a-b, 1999; de la Peña y Rumboll, 1998). La descripción de la dieta en la bibliografía indica larvas de insectos que extrae de la corteza, como también gusanos, larvas, semillas y granos (de la Peña, 2001), en tanto que Navas (1982) menciona insectos y frutos. Para el área en consideración se aportan los primeros datos sobre su dieta. Siguiendo el criterio de Kirkconnel (1992) se lo incluye en el gremio de las aves omnívoras por picoteo y espigueo, básicamente en follaje y suelo.
MOLOTHRUS RUFOAXILLARIS (TORDO PICO CORTO)
Todos los estómagos analizados (n =5), correspondientes al período 1990-1991, contuvieron
alimento.
El espectro trófico, basado en la identificación de 258 presas estuvo representado por 8 entidades taxonómicas , de las cuales cinco (5)pertenecen a la fracción animal y las tres (3) restantes a la fracción vegetal. (Tabla 13).
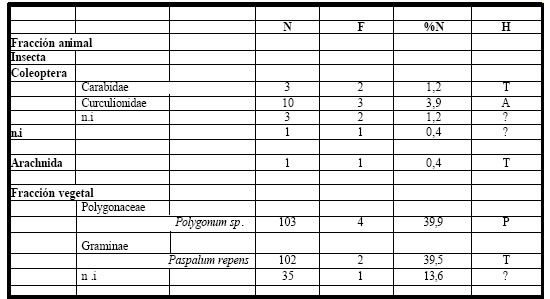
Tabla 13. Espectro trófico de Molothrus rufoaxilaris. N = nº de organismos; F = frecuencia de captura; % = porcentaje numérico; H = hábitat (A: acuático, T: terrestre, P: palustre); ni = no identificado
La fracción vegetal fue numéricamente la más importante, hallándose un total de 240 semillas, representadas por especies acuáticas arraigadas como Polygonum sp. y Graminae (Paspalum repens y no identificadas), y a las que le correspondió el 93% del total de las ingestas. La fracción animal, fue menos importante y le correspondió el 7% del total, estuvo integrada por formas acuáticas y terrestres tales como Curculionidae, Carabidae, insectos no identificados y Arachnida.
La diversidad trófica osciló entre 0,26 y 0,89, siendo más frecuente la correspondiente al intervalo de diversidad media (0,51 - 1,00). En tanto que la diversidad trófica acumulada (Hk) fue de 1,7. Con la suma de las 5 muestras, la curva tiende a la estabilización, lo que permitiría alcanzar el punto t (Magurran, op.cit.). (Fig.25).
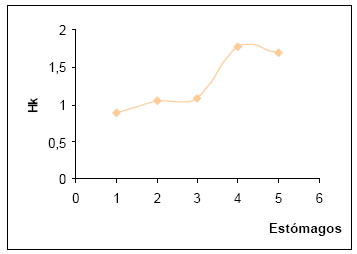
Fig. 25. Diversidad trófica acumulada (Hk) de Molothrus rufoaxilaris.
Por medio de la aplicación del índice de importancia relativa (IRI), la contribución de cada categoría de alimento tuvo los siguientes valores: Semillas = 6940; Coleoptera y Arachnida = 2327 (Fig.26). El régimen alimenticio del ave es proporcionado por estos valores, y destaca la importancia predominante que tiene la fracción vegetal como alimento principal, en tanto que los restantes taxa (Coleoptera y Arachnida), constituyen alimentos accesorios.
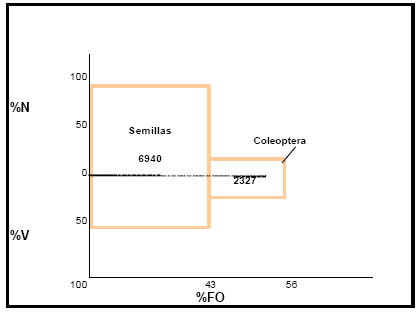
Fig. 26. Índice de importancia relativa (IRI) de Molothrus rufoaxilaris. %N = porcentaje numérico; %V = porcentaje volumétrico; %FO = frecuencia de ocurrencia.
La amplitud del nicho trófico (AN) tuvo un valor de 0,1 para otoño, 0,5 para primavera y 0,7 para verano, no se contó con datos de invierno. El valor bajo de otoño, se debió a que la muestra está maximizada por la presencia de semillas de Polygonum sp., en tanto que los ítemes restantes son ostensiblemente menores. En cambio, los valores altos de primavera y verano indican que si bien se encuentran representadas la mayoría de los taxa, las muestras son más homogéneas.
La eficiencia alimentaria alcanzó un valor del 96%, y el cual revela el ajuste de la especie con el medio. En lo que respecta al ritmo diario de actividad alimentaria (IF) tuvo un pico de actividad entre las 10:00 y las 12:00 manteniéndose constante hasta las primeras horas de la tarde, 14:00 horas.
El tamaño de las presas osciló entre 1 y 5 mm, siendo más abundantes las correspondientes al intervalo (2,5 - 4) y que correspondió a los Arachnida, Coleoptera con Curculionidae , coleópteros no identificados, a las semillas de Polygonum sp, y a las Graminae. Las de menor tamaño estuvieron representadas por las semillas de Paspalum repens, Polygonum sp, en tanto que las de mayor talla resultaron ser algunos Curculionidae y Carabidae no identificados.
El valor obtenido en la preferencia de hábitat (Pi) fue de 0,3 para la vegetación acuática.
En general los escasos antecedentes para esta especie se refieren aspectos que hacen a su identificación, distribución, dinámica poblacional (Nores e Izurieta, 1981, 1982; Miatello et al., 1999; Camperi, 1989; Biolé y Baliño, 1985; Capurro y Butcher, 1986), en tanto en lo que hace a su dieta, Harrison (1978) señala una composición integrada por insectos, carne, pan y bellotas. En cambio este aporte, si bien cuenta con un escaso número de muestras, aporta un espectro trófico integrado por insectos tanto terrestres (Carabidae), como aquellos asociados a la vegetación acuática (Curculionidae y Arácnida), también semillas de Polygonum sp. y Paspalum repens. Incorporándolo al gremio de los básicamente insectívoros, explorador de tallos troncos y hojas.
Interrelaciones tróficas
El análisis integral de las relaciones tróficas, que brinda una visión teórica de la posición relativa de cada especie dentro de la comunidad, se realizó a partir de una matriz básica de datos, en donde cada especie estudiada constituyó una unidad taxonómica operativa (OTU). Los caracteres codificados fueron los siguientes: porcentaje de ocurrencia, porcentaje numérico, porcentaje volumétrico de los principales ítemes alimentarios, representados por los valores del IRI, y el tamaño medio de las presas. El análisis presenta en su fenograma (Fig.27) que no existe una evidencia clara que exprese agrupamientos. Por el contrario, si bien se observan tendencias que estarían indicando mayor o menor grado de similitud, al menos en dos grandes grupos, en la apreciación general todas las especies integran un gran grupo trófico. Esto expresa que comparten la gran mayoría de los ítemes alimentarios como queda claramente demostrado en el análisis de los espectros alimentarios y representación gráfica de los índices de importancia.
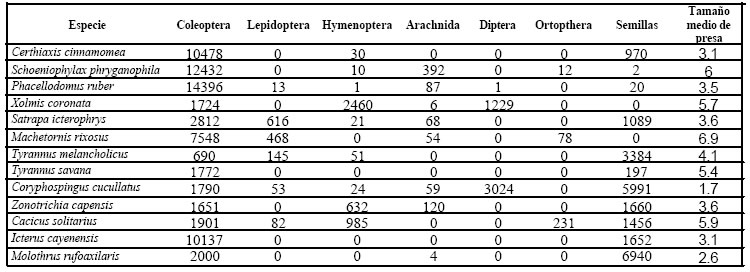
Matriz básica de datos utilizados en el fenograma de la Fig. 27
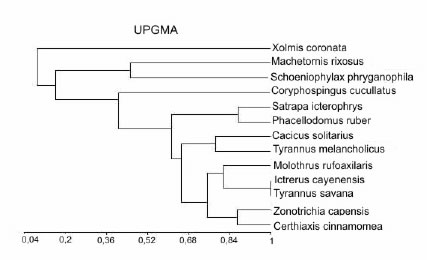
Fig.27. Coeficiente de Spearman
En relación a las especies tratadas en este trabajo, se puede señalar que, mucho de los ítemes mayoritarios identificados en los espectros alimentarios son coincidentes. En este sentido, esto ocurre para algunas especies tanto desde el punto cuali y cuantitativo, y en otros solamente en la que hace a su presencia, aunque numéricamente el aporte sea poco significativo. La estructura trófica observada marca un predominio de los insectos, que son dentro de la fracción animal el íteme de mayor relevancia para todas las especies. Esto ocurre particularmente con los Coleoptera tanto con formas acuáticas (Dytiscidae, Hydrophilidae y Curculionidae) como también con los terrestres como los Carabidae. Otros grupos de insectos asimismo presentes en la mayoría correspondieron a los Hymenoptera con Formicidae (Atta sp., Acromyrmxs humilis), Chrysomelidae y Arachnida (Pysauridae). En lo que hace a la fracción vegetal, la ocurrencia es más notable aún, ya que se restringe a las especies acuáticas (Paspalum sp, Polygonm sp., etc.) y a trepadoras apoyantes (Cissus sicyoides, Urera aurantiaca, etc.), hecho que se asocia a la estacionalidad de los recursos. En general los insectívoros (Certhiaxis cinnamomea, Phacellodomus ruber, Schoeniophylas phryganophila, Xolmis coronata, Icterus cayenensis, entre otros) predominan sobre los granívoros (Tyrannus melancholicus, Corhypospingus cucullatus, Zonotrichia capensis, Molothrus rufoaxilaris). La existencia de la omnivoría observada se ve favorecida por diferentes razones. En primer lugar pueden aceptar varios tipos de alimentos, simplemente porque al encontrarlos les resulta más beneficioso incorporarlos que ignorarlos. Una dieta mixta mantiene diferentes concentraciones que, en la sumatoria puede contribuir al aporte que estas aves necesitan conforme a sus requerimientos. En cuanto al registro de ítemes alimentarios propios y característicos de algunas especies, se corresponden con técnicas de forrajeo particulares, tales como la captura en vuelo, por espigueo, o mediante la exploración de troncos, tallos y hojas en los "enriedos". En lo referente a Certhiaxis cinnamomea se registró en su dieta semillas de Graminae, Curculionidae (Neochetina sp.) y Noteridae (Suphisellus sp.); en Phacellodomus ruber Gryllotalpidae, Elateridae , Bellostomatidae, Tenebrionidae, Diptera y Arachnida (Lycosidae); en Schoeniophylax phryganophila Orthoptera (Paulinia sp.). En lo que hace a Xolmis coronata, Diptera (Simulidae y Muscidae con Musca domesticus), Satrapa icterophrys, Lepidoptera (Noctuide sp.); por su parte Tyrannus melancholicus, frutos y semillas de Muehlenbeckia sp, Vespidae, Halictidae, larvas de insectos y de Lepidoptera, en tanto que, Machetornis rixosus formas acuáticas de Orthoptera (Marellia sp.), Tyrannus savana, Diptera (Muscidae, Simulidae, Culicidae), Ephemeroptera, Odonata (Zygoptera) y semillas de Solanaceae (Lycium sp.). Los emberizidos con Coryphospingus cucullatus registró numerosos gastrolitos pequeños y larvas de Lepidoptera; Zonotrichia capensis, Formicidae (Camponothus sp.), Orthoptera (Cornops aquaticum). En Icterus cayenensis se registró, Elateridae y semillas de Compositae; en Cacicus solitarius, Orthoptera (Dichroplus sp.) y semillas de Leguminosae y Molothrus rufoaxilaris registró en su dieta, semillas de Paspalum repens.
De las trece especies, un total de seis (46%) pertenecen al gremio de las básicamente insectívoras de follaje y espigueo con picoteo, en tanto que cuatro (31%) al de los insectívoros de percha y explorador de tallos, hojas y troncos, siendo el gremio de los básicamente insectívoros de percha con revoloteo, persecución y captura en vuelo, el que tiene la menor representación (23%). La manipulación de insectos, presentes en todas las especies requieren un tiempo despreciable (Begon, et al. 1988; Begon, 1989) y casi siempre exitoso para las aves, particularmente las de todos los gremios a que corresponden los pájaros que han sido estudiados. Por consiguiente un ave espigadora tiene algo que ganar y virtualmente nada que perder si consume las presas en cuanto las encuentra y la productividad total queda maximizada con una dieta amplia. En condiciones de gran disponibilidad trófica, esto es así, la comunidad adquiere una mayor estabilidad ya que pueden comportarse como residentes permanentes. Las variaciones en la amplitud del nicho observados en algunas de las especies (Pacellodomus ruber, Tyrannus melancholicus, Corhypospingus cucullatus, Icterus cayenensis, Molothrus rufoaxilaris), expresan que el nicho efectivo se manifiesta estacionalmente. Esta apreciación es válida igualmente para todas, ya que en algunos el número de estómagos analizados ha sido bajo por lo que no se pueden sostener con mayor énfasis los aspectos del nicho fundamental y el efectivo. No obstante se considera una aproximación referida a las propiedades de los nichos fundamentales. En este sentido es importante tener en cuenta que los nichos están diferenciados por la forma de utilizar los recursos, los lugares y los tiempos (Schoener, 1974; Mc Naughton y Wolf, 1984).
Conclusión
Conforme a las observaciones realizadas, la metodología utilizada y de acuerdo a los resultados obtenidos, las especies de Passeriformes estudiadas, han desarrollado mecanismos de segregación, que les permiten coexistir. La gran variedad de organismos observados en sus espectros tróficos muestran la plasticidad que tienen estas aves en lo que hace a su alimentación, como consecuencia de la abundancia de recursos tróficos existente en un área como la del valle de inundación del río Paraná, donde la oferta de hábitats (GUVAS) no sólo les brinda alimento, sino también un lugar para refugio, protección y reproducción. Es evidente, que si bien no se cuantificó la oferta, la disponibilidad supera la demanda y por ende los alimentos incorporados reflejan su disponibilidad y accesibilidad, aspecto que queda condicionado al diseño óptimo de cada especie estudiada, particularmente en lo que hace a sus ajustes morfológicos (ecomorfología), respuestas fisiológicas y al comportamiento específico. En resumen, cada una representa un nicho, y si bien existen similitudes, existen también sutiles mecanismos que les permite coexistir, evitando la exclusión competitiva. Este aporte, si bien cuenta en algunos casos con un bajo número de muestras, que además corresponden a un amplio período de muestreos exploratorios, se considera el primero que contempla para el valle de inundación del río Paraná el estudio cuali- cuantitativo de la dieta de trece especies de Passeriformes, como así también al ritmo de actividad alimentaria, eficiencia y selección del hábitat, técnicas de forrajeo y grupos funcionales. Futuros estudios permitirán ampliar estos conocimientos particularmente de un área sobre la que se impulsan proyectos de ingeniería como dragado y represas, además de graves problemas de contaminación.
Bibliografía
Acosta Cruz, M.; O. Torres y L. Mugica Valdés. 1988. Subnicho trófico de Dendrocygna bicolor (Vieillot) (Aves: Anatidae) en dos áreas arroceras de Cuba. Ciencias Biológicas., 19-20: 41-50
Baratini, P. 1945. Las aves de Paysandú. Anales Lic. Dep. Paysandú, 53 p.
Barbarskas, M.; V. Verga y F. Filiberto. 1996. Nuevos registros de aves para la provincia del Neuquén. Nuestras aves, 14 (34): 44-46.
Begon, M. 1989. Ecología animal. Modelos de cuantificación de poblaciones. Trillas, México, 134 p.
Begon, M.; J.L. Harper y C.R. Towsend. 1988. Ecología. Individuos, Poblaciones y Comunidades. Omega, Barcelona, 886 p.
Belton, W. 1984. Birds of Rio Grande do Soul, Brasil. Part. 1. Rheidae through Furnariidae. Bulletin of the American Museum of Natural History. Vol. 178: Article 4. New York.
Beltzer, A.H. 1981. Nota sobre fidelidad y participación trófica de Egretta alba egretta (Gmelin, 1789) y Egretta thula thula (Molina, 1782) en ambientes del río Paraná medio (Ciconiformes: Ardeidae). Revista de la Asociación de Ciencias Naturales del Litoral, 12: 136-139.
Beltzer, A.H. 1983a. Fidelidad y participación trófica del macá grande (Podiceps major) y su relación con el biguá común (Phalacrocorax olivaceus) en ambientes del río Paraná medio (Aves: Podicepedidae y Phalacrocoracidae). Historia Natural, 3(2): 17- 20.
Beltzer, A.H. 1983b. Notas sobre fidelidad y participación trófica del biguá común (Phalacrocorax olivaceus) en ambientes del río Paraná medio (Pelecaniformes: Phalacrocoracidae). Revista de la Asociación de Ciencias Naturales del Litoral, 14(2): 111- 114.
Beltzer, A.H. 1983c. Alimentación del benteveo (Pitangus sulphuratus) en el valle aluvial del río Paraná medio (Passeriformes: Tyrannidae). Revista de la Asociación de Ciencias Naturales del Litoral, 14: 47- 52.
Beltzer, A.H. 1984b. Atación de Phaetusa simplex (Gmelin, 1789) (Aves: Sternidae) en el valle aluvial del río Paraná medio, Argentina. Iheringia, Serie Zoológia, 64: 47- 52.
Beltzer, A.H. 1985. Ecología alimentaria de Aramides ypecaha (Aves: Rallidae) en el valle aluvial de río Paraná medio (Argentina). Revista de la Asociación de Ciencias Naturales del Litoral, 16(1): 73- 83.
Beltzer, A.H. 1986. Cacicus solitarius hospedante de Molothrus bonariensis bonariensis (Aves: Icteridae). Revista de la Asociación de Ciencias Naturales del Litoral, 17 (2): 215 – 216.
Beltzer, A.H. 1990a. Biología alimentaria del gavilán común Buteo magnirostris (Aves: Accipitridae) en el valle aluvial del río Paraná medio, Argentina. Ornitolgía Neotropical, 1(1): 1- 7.
Beltzer, A. H. 1990b. Biología alimentaria del verdón común Embernagra platensis (Aves: Emberizidae) en el valle aluvial del río Paraná medio, Argentina. Ornitolgía Neotropical, 1(1): 25- 30.
Beltzer, A.H. 1991. Aspects of the foraging ecology of the waders Tringa flavipes, Calidris fuscicollis and Charadrius collaris (Aves: Scolopacidae and Charadriidae) in Del Cristal Pond (Santa Fe, Argentina). Studies on Neotropical Fauna and Environment, 26 (2): 65- 73.
Beltzer, A.H. 1995. Los Ardeidae del Paraná medio. Dimensiones del nicho y mecanismos de aislamiento. Tesis de Maestría, Facultad de Formación Docente en Ciencias (UNL), Santa Fe, 85 p.
Beltzer, A.H. 1997. Cinclodes fuscus (Aves: Furnariidae). A bentophagous bird in the Midlle Paraná River Floodplain, Argentina. Natura Neotropicalis, 28(2): 85-93
Beltzer, A.H.1998. Biología alimentaria del Verdón Común Embernagra platensis platensis (Aves: Emberizidae) en el valle aluvial del río Paraná medio, Argentina. Ornitología Neotropical 1:25-30.
Beltzer, A.H. y J.J. Neiff. 1992. Distribución de las aves en el valle del río Paraná. Relación con el régimen pulsátil y la vegetación. Ambiente Subtropical, 2: 77- 102.
Biole, F.V. y V.V. Baliño. 1985. La avifauna de nuestros parques nacionales. Nuestras aves, 3(6): 21-24
Brillouin, L. 1965. Science and information theory. Academic Press, New York, 245 p.
Brooks, D.M. 1997. Avian seasonality at a locality in the Central Paraguayan Chaco. Hornero, 14(4): 193-203.
Burkart, A. 1957. Ojeada sinóptica sobre la vegetación del Delta del Paraná. Darwiniana, 11: 457- 461.
Camperi, A.R. 1989. Localidades nuevas para ictéridos de la Argentina (Aves: Passeriformes). Neotropica, 35 (94): 91- 94.
Camperi, A.R. 1992. Estudio sobre aves colectadas en el extremo sudoeste de la Provincia de Buenos Aires. Neotropica, 38 (100) : 124-140
Camperi, A.R. y C.A. Darrieu. 2001. Estudio de una colección de aves del sur de la provincia de Misiones, República Argentina. Physis, Sec. C, 58 (134 – 135): 79 – 83.
Canevari, M.; P. Canevari; G. R. Carrizo; G. Harris; J. Rodriguez Mata y R.V. Straneck. 1991a. Nueva guía de las aves argentinas. Acindar, Buenos Aires, T. 1, 411 p
Canevari, M.; P. Canevari; G.R. Carrizo; G. Harris; J. Rodriguez Mata y R.v. Straneck. 1991b. Nueva guía de las aves argentinas. Acindar, Buenos Aires, T. 2, 488 p.
Canevari, P. y T. Narosky. 1995. Cien aves argentinas. Albatros, Buenos Aires, 126p.
Capurro, H. A. y E.H. Butcher. 1982. Poblaciones de aves granívoras y disponibilidad de semillas en el bosque chaqueño del Chamical. Ecosur, 9 (8): 117 - 131
Capurro, H.A. y E.H. Butcher. 1986. Variación estacional en la comunidad de aves del bosque chaqueño del Chamical. Physis, Sec. C., 44 (106): 1-6.
Cody, M.L. 1975a. Ecological aspects of reproduction. p.461-512. In: Farner, D.S. y V.R. King.(eds.). Avian biology. Academic Press, New York.
Cody, M.L. 1975b. Habitat selection in birds. Academic Press, New York, 558 p.
Contreras, J.R. 1980- 81. Consideraciones sobre las asociaciones interespecíficas de aves Passeriformes de la región selvática costera del Alto Paraná en la Provincia de Corrientes, Argentina. Facena, 4: 61-75.
Contreras, J.R. 1983. Notas sobre el peso de aves argentinas III. Historia Natural, 3(8): 95 – 96.
Contreras, J.R.; Y. E. Davies. 1980. Aportes al conocimiento del peso de las aves argentinas. Revista de la Asociación de Ciencias Naturales del Litoral,11:21 – 29.
Chikilián, M.; M.G. Celaya y N. Bee de Speroni. 1993 – 94. Morfohistología y citoquímica comparada del tracto digestivo en tres especies de aves (Emberizidae). Revista de la Asociación de Ciencias Naturales del Litoral, 24–25: 35– 48.
D’Angelo, M.L. 1997. Geografia en Nueva Enciclopedia de la Provincia de Santa Fe. Sudamérica. Tomo I, 365 p.
de la Peña, M.R. 1987. Nidos y huevos de aves argentina. Lux, Santa Fe, 229 p.
de la Peña, M.R. 1988a. Guía de aves argentinas. T. V. Lux, Santa Fe, 112 p.
de la Peña, M.R. 1988b. Guía de aves argentinas. Passeriformes. Lola, Buenos Aires, 112 p.
de la Peña, M.R. 1993. Fauna del Departamento Las Colonias (Santa Fe). Muncipalidad de Esperanza, Santa Fe, 93 p.
de la Peña, M.R. 1994. Observaciones acerca de agregaciones multiespecíficas de aves en la provincia de Santa Fe, Rep. Argentina. Nótulas Faunísticos, 54: 1-5.
de la Peña, M.R. 1997a. Nidos y huevos de aves argentinas. Guía de campo. Fundación Habitat, Santa Fe, 369 p.
de la Peña, M.R. 1997b. Lista y distribución de las aves de Santa Fe y Entre Ríos. Lola, Buenos Aires, 126 p.
de la Peña, M.R. 1999. Aves argentinas. Lista y distribución. Lola, Buenos Aires, 244 p.
de la Peña, M.R. 2001. Observaciones de campo en la alimentación de las aves. FAVE, UNL, 15 (1): 99-107.
de la Peña, M.R. y M. Rumboll. 1998. Birds of Southern South America and Antarctica. Collins, London, 304 p.
Duncan, P. 1983. Determination of the use of habitat by horses in Mediterranean wetland. Journal of Animal Ecology, 52: 93-109.
Fiora, A. 1934. El peso de las aves. Hornero, 5: 353 – 363.
Haene, E.H.; S. F. Krapovickas; F. Moschione y D. Gómez. 1996. Observaciones y comentarios biogeográficos sobre la avifauna del este de la Provincia de San Juan, Argentina. Hornero, 14 (1-2): 48-58
Harrison, C.V.O. 1978. Bird families of the world. Elsevier, Oxford, 268 p.
Hurtubia, J. 1978. Trophic diversity measurement in sympatric species. Ecology, 54 (4): 885-890
Iriondo, M. y E.C. Drago. 1972. Descripción cuantitativa de dos unidades geomorfológicas de la llanura aluvial del Paraná medio, República Argentina. Revista de la Asociación Geológica Argentina, 27(2): 143 – 154.
Jordano, P. 1981. Alimentación y relaciones tróficas entre Passeriformes en paso otoñal por una localidad de Andalucía central. Doñana Acta Vertebrata, 8: 103-124
Kirckonnel, A.; O. Garrido; R. Posada y S. Cubillas. 1992. Los grupos tróficos de la avifauna cubana. Poeyana, 415 : 1-21
Klimaitis, J. F. y F.N. Moschione. 1987. Aves de la reserva integral de selva marginal de Punta Lara y sus alrededores. Reseña de sus relaciones con los principales ambientes y comunidades vegetales. Dirección de Recursos Naturales y Ecología, Buenos Aires, 120 p.
Kovach, W.L. 1999. MVSP- Multivariate Statical Package For IBM- PC, versión 3.0.
Latino, S. y A.H. Beltzer. 1999. Ecología trófica del benteveo Pitangus sulphuratus (Aves: Icteridae) en el valle de inundación del río Paraná, Argentina. Orsis, 14: 69-7
Levins, R. 1968. Evolution in changing environments. Princeton University Press, New Jersey, 120 p.
Lucero, M.M. y E.A. Alabarce. 1980. Frecuencia de especies e individuos en una parcela de la selva misionera (aves). Revista del Museo Argentino de Ciencias Naturales “Bernardino Rivadavia” e Instituto Nacional de Investigaciones de Ciencias Naturales y Ecología, 2 (7): 117 – 123.
Magurran, A.E. 1989. Diversidad ecológica y su medición. Vedra, Barcelona, 200 p.
Maitland, P.S. 1978. Biology. Blackie, London, 244 p.
Marelli, C.A. 1919. Sobre el contenido estomacal de algunas aves. Hornero 1: 221 – 228.
Margalef, R. 1977. Ecología. Omega, Barcelona, 951 p.
Margalef, R. 1983. Limnología. Omega, Barcelona, 1010 p.
Marone, L. 1992. Estatus de residencia y categorización trófica de especies de aves en la reserva de la biosfera deÑancuñán. Mendoza. Hornero, 13 (3): 207-210
Martínez, M. M. 1993. Las aves y la limnología. p. 127-142. En: Boltovskoy, A. y H. López (eds.).Conferencias de Limnología. La Plata, Buenos Aires.
Maule, A.G. y H.F. Horton. 1984. Feeding ecology of walleye, Stizostedion vitreun vitreun in the MidColumbia river, with enphasis on the interaction between walleye and juvenile anadromus fishes. Fisheries Bulletin, 82: 411-418.
Mc Naughton, S.V y L. Wolf. 1984. Ecología general. Omega, Barcelona, 713 p.
Meyer de Schauensee, R. 1982. A guide to the birds of South America. Academy of Natural Sciences of Philadelphia, Philadelphia, 498 p.
Miatello, R.; V. Baldo; M. Ordano; C. Rosacher y L. Biancucci. 1999. Avifauna del Parque Nacional Quebrada del Condorito y reserva Hídrica Provincial de Achala- Córdoba, Argentina. Secretaría de Agricultura, Ganadería y Recursos Naturales, Córdoba, 193 p.
Morrone, J.J. 2001. Biogeografía de América Latina y el Caribe. M&T- Manuales & Tesis SEA, vol. 3. Zaragoza, 148 p.
Narosky, T. y D. Izurieta. 1993. Guía para la identificación de las aves de Argentina y Uruguay. Asociación Ornitológica del Plata, Buenos Aires, 345 p.
Navas, J. R. 1982. Introducción a la avifauna del Parque Nacional El Palmar. Anales Parques Nacionales, 15: 35-64.
Neiff, J.J. 1975. Fluctuaciones anuales en la composición fitocenótica y biomasa de la hidrofitia en lagunas isleñas del Paraná medio. Ecosur, 2 (4): 153- 183.
Neiff, J.J. 1978. Fluctuaciones de la vegetación acuática en ambientes del valle de inundación del Paraná medio. Physis, Secc. B, 38 (95): 41- 53.
Neiff, J.J. 1986a. Las grandes unidades de vegetación y los ambientes insulares del río Paraná en su tramo Candelaria- Itá Ibaté. Revista de la Asociación de Ciencias Naturales del Litoral, 17 (1): 7- 30.
Neiff, J.J. 1986b. Sinopsis ecológica y estado actual del Chaco oriental. Ambiente Subtropical., 1: 5- 35.
Neiff, J.J. y J.A. Orellana. 1972. Diferenciación de ambientes en una cuenca isleña del Paraná medio sobre la base de las unidades de vegetación y suelos asociados. Revista de la Asociación de Ciencias Naturales del Litoral, 3: 3- 17.
Nores, M. y D. Izurieta. 1981. Nuevas localidades para aves argentinas. Parte II. Historia Natural, 2 (5): 33 – 42.
Nores, M. y D. Izurieta. 1982. Nuevas localidades para aves argentinas. Parte II. Historia Natural, 2 (13): 101-104.
Ochoa de Masramón, Dora. 1979. Contribución al estudio de las aves de San Luis. Hornero, 12 (1): 59 – 68.
Olrog, C.C. 1979. Nueva lista de la avifauna argentina. Opera Lilloana, 27: 1-324
Ordano,M.; A. Bosisio; B. Boscarol; A. Beltzer; G. Paporello de Amsler. 1999. Stomach contents of thirty six bird species from Northern Argentina. Ceres, 46 (267): 555- 563.
Pianka, E.R. 1982. Ecología evolutiva. Omega, Barcelona, 365 p.
Pinkas, J.; M.S. Oliophant y Z.L. Iverson. 1971. Food habits of albacore bluefin tun and bonito in California waters. Department of Fish and Game, Fish Bulletin, 152: 1-105.
Root, R.B. 1968. The niche explotation pattern of Bluegray Catcher. Ecological Monographs, 37: 317- 350.
Salvador, S.A. 1988. Datos de pesos de aves argentinas. Hornero 13: 78 – 83.
Schoener, T.W. 1974. Resource partitioning in ecological communities. Science, 185: 27-39.
Soave, G.E., G. Marateo, P. Rey; D. Glag y C.A. Darrieu. 1999. Evolución estacional de los ensambles de aves en un talar del nordeste de la Prov. de Bs. As., Argentina. Comisión de Investigaciones Científicas. CIC. La Plata, 55: 1-11.
Tubaro, P.L.; F.M. Gabelli; I.M. Mozetich y E. T. Segura. 1996a. Evaluación de la hipótesis de la detección alertada en el canto del chingolo (Zonotrichia capensis) I. Experimentos con playbacks de cantos completos y fraccionados. Hornero, 14 (3): 27- 34.
Tubaro, P.L.; F.M. Gabelli; I.M. Mozetich y E.T. Segura. 1996b. Evaluación de la hipótesis de la detección alertada en el canto del chingolo ( Zonotrichia capensis) II. El efecto de la degradación acústica en los playbacks con cantos completos y fraccionados. Hornero, 14 (3): 35-43.
Tubaro, P.L.; P.T. Handford y E.T. Segura. 1997. Song learning in the Rufous – Collared Sparrow (Zonotrichia capensis). Hornero, 14 (4): 204 – 210.
Viulleumier, F. 1994. Nesting, behavior, distribution and speciation the Patagonian y Andean Ground Tyrants (Myiotheretes, Xolmis, Neoxolmis, Agrioirnis and Muscisaxicola). Ornitología Neotropical, 5 (1): 1-55.
Wilson, E.O. 1974. Sociobiología. La nueva síntesis. Omega, Barcelona, 701 p.
Zapata, A.R. 1975. Aves observadas en las proximidades de la confluencia de los ríos Uruguay y Gualeguaychú. Provincia de Entre Ríos. Hornero, 11 (5): 307-409.
Zapata, A.R. y R. Novatti. 1995. Passeriformes albinos en la colección del Museo de La Plata. Revista de la Asociación de Ciencias Naturales del Litoral, 26 (1): 69 – 71.
Ziswiler, V. 1980. Zoología especial Vertebrados. T. 2. Omega, Barcelona, 413 p