Estudios cromosómicos en saurios y anfisbénidos del litoral fluvial argentino y área de influencia. Estado del conocimiento
Alejandra HERNANDO 1 y Blanca ALVAREZ 1
1 Dpto. de Biología. Fac. de Ciencias Exactas y Naturales y Agrimensura, Universidad Nacional del Nordeste Av. Libertad 5450 (Campus) W 3404 AAS(3400) Corrientes, ArgentinaAbstract: CHROMOSONIC STUDIES ON SAURIA AND ANPHISBENIDS. Morphological characters are traditionally involbed in taxonomic studies of Squamata. However, cytogenetic information from chromosome number, size and shape to molecular level can be an important contribution for systematics and phylogenetic analysis. In this paper, we summarize the karyotypic data available for lizards and amphisbaenians species distributed in the Argentinean littoral region. Chromosome formulae, banding patterns when exist and a brief remark about genera or families cytogenetic features are given..
Key words: Lizards - Amphisbaenians - Cytogenetics - Karyotypes - Chromosome banding - Argentinean littoral region.
Palabras clave: Saurios - Anfisbénidos - Citogenética - Cariotipos - Bandeos cromosomas - Litoral fluvial argentino.
Introducción
Los caracteres cromosómicos pueden brindar información no evidente a nivel fenético (como en el caso de las especies crípticas) y, dependiendo del nivel de análisis, son herramientas importantes para resolver problemas sistemáticos. Además, como los caracteres cariológicos, morfológicos, inmunológicos, isoenzimáticos no evolucionan de manera paralela las comparaciones del grado de diversificación de los cariotipos con el grado de divergencia de otros caracteres son útiles para inferir relaciones filogenéticas (Peccinini- Seale 1981).
Los cromosomas pueden analizarse teniendo en cuenta la forma, tamaño, número y comportamiento durante la meiosis y mitosis. Con el desarrollo de las técnicas de coloración diferencial y de hibridación in situ es posible identificar los cromosomas por sus patrones característicos de bandas. Esto permite la descripción de reordenamientos estructurales, localización de marcadores cromosómicos e identificación de cromosomas homólogos y homeólogos.
Los datos cromosómicos no pueden ser interpretados aisladamente sino integrados con otros caracteres, fundamentalmente para establecer características cariotípicas primitivas y derivadas contrastando con hipótesis basadas en caracteres independientes (Sites y Reed 1994).
Las diferencias en la estructura de los cromosomas se correlacionan con la diferenciación taxonómica aunque el rol de los reordenamientos cromosómicos en el proceso de especiación es tema de debate (Coyne y Orr 1998, Rieseberg 2001).
En los saurios y anfisbénidos, los caracteres morfológicos constituyen la fuente de datos tradicionalmente usada en taxonomía y, a diferencia de otros grupos zoológicos como los mamíferos, sólo recientemente se han encarado estudios cromosómicos para resolver problemas sistemáticos o proponer relaciones evolutivas, aunque de manera dispar entre géneros, familias o faunas de los diferentes continentes.
Estado del conociminento
A continuación se describen los datos cromosómicos conocidos para las especies citadas por Alvarez et al. (2002) para el litoral fluvial argentino y su área de influencia.
FAMILIA POLYCHROTIDAE
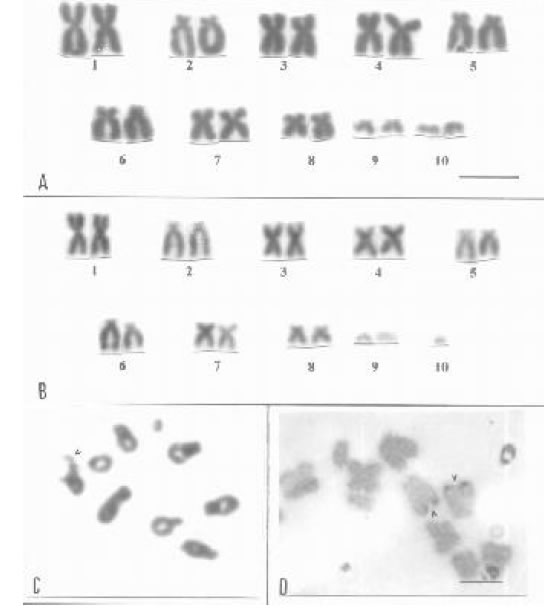
En Polychrus acutirostris las hembras tienen 2n = 20 (16 M + 4 m) y los machos 2n = 19 (16 M +
3 m). Los macrocrocromosomas y microcromosomas son bibraquiados, subtelocéntricos y
acrocéntricos (NF: 32/30) (Hernando 1995; Bertolotto et al. 2001) (Figura 1 A y B). La diferencia en
el número diploide entre los sexos se explica por la presencia de un sistema múltiple de determinación
del sexo del tipo X1X1X2X2:X1X2Y por lo que en meiosis se observan 8 bivalentes y un
trivalente (Figura 1C). La región organizadora del nucleolo se localiza en el par 2, en posición
telomérica (Figura 1D). A través de técnicas de hibridación in situ (FISH) se localizaron secuencias
teloméricas (TTAGGG)n en posición intersticial (Bertolotto et al. 2001).
En Polychrus, que comprende sólo 6 taxa, se destaca una variabilidad de números diploides y morfologías de los cromosomas al comparar las especies con cariotipo conocido: P. marmoratus (2n = 30 en hembras y 2 n = 29 en machos, NF: 30), P. femoralis (2n = 26, NF: 28), P. peruvianus (2n = 28 en hembras y 2 n = 27 en machos, NF: 28) (Gorman et al. 1967, Gorman 1973, Peccinini 1970, Beçak et al. 1972, Bertolotto et al. 2001).

Fig. 1. Polychrus acutirostris. A) Cariotipo de hembra, 2n= 20. B) Cariotipo de macho, 2n = 19. C) Meiosis de macho mostrando un trivalente D) Metafase parcial de médula ósea con un par de macrocromosomas portador de RON. (Barra 10 mm, en todas las figuras)
FAMILIA LEIOSAURIDAE
Anisolepis longicauda tiene un cariotipo 2 n = 36 (12 M + 24 m, NF: 48) (Hernando, 1995) que es
similar al de otra especie del género: A. grilli (Gorman et al. 1967).
Este cariotipo, considerado como conservador para los Iguania, es compartido por otros géneros de la familia: Enyalius (Bertolotto et al. 2002), Pristidactylus (Pinna-Senn et al. 1987) y Urostrophus (Pellegrino et al. 1999).
En esta familia, se describió el sistema XX/XY de determinación del sexo que involucra a un par de microcromosomas (Bertolotto et al. 2002)
FAMILIA LIOLAEMIDAE
Liolaemus azarai presenta un cariotipo considerado conservador: 2n = 34 (12 M + 22 m) (Hernando
2003). Los macrocromosomas son metacéntricos y submetacéntricos, los microcromosomas se
presentan puntiformes con el par 7 acrocéntrico de tamaño intermedio entre macros y
microcromosomas (Fig. 2A).
Un patrón de bandas C caracterizado por heterocromatina constitutiva en las regiones pericentroméricas de los macrocromosomas es compartido entre las especies de Liolaemus del este de los Andes (Fig. 2B) así como el par 2 que en la región distal del brazo largo porta la constricción secundaria (Navarro 1992, Bertolotto et al. 1996, Aiassa et al. 1998, 1999, Hernando 2003). En esta región, las tinciones argénticas revelaron sitios activos de genes ribosomales en Liolaemus azarai, L.chacoensis (Hernando 2003), L. occipitalis, L. lutzae y L. wiegmannii (Bertolotto et al. 1996). Bertolotto et al. (2002) señalan que misma es un segmento conservador compartido con otros géneros de“iguánidos” como Tropidurus, Strobilurus, Pristidactylus, Polychrus y Sceloporus.
Liolaemus es un género que exhibe una notable diversidad cariotípica con un amplio rango de
números diploides que varían entre 2n = 30 a 2n= 44.
Desde el punto de vista cromosómico, Lamborot y Alvarez-Sarret (1989) reconocen dos grupos
de Liolaemus:
• especies con cariotipo primitivo 2n = 30 a 34, con 12 macrocromosomas bibraquiados y 18 a 22 microcromosomas. Las fusiones céntricas a partir de un cariotipo con 24 microcromosomas son los eventos propuestos para explicar los diferentes números de microcromosomes.
• especies con cariotipos derivados, con números cromosómicos mayores como resultado de fisiones de macrocromosomas metacéntricos y submetacéntricos, y sin diferencias entre macro y microcromosomas: 2n = 38 - 44, NF: 44 a 52.
Si bien las fisiones céntricas son consideradas el mecanismo principal en la evolución cromosómica de Liolaemus, también se propusieron inversiones pericéntricas y adición de heterocromatina (Lamborot 1991; Iturra et al. 1994).
En el género Liolaemus, se describió el sistema de determinación del sexo del tipo XX/XY (Iturra et al. 1994, Bertolotto et al. 1996).
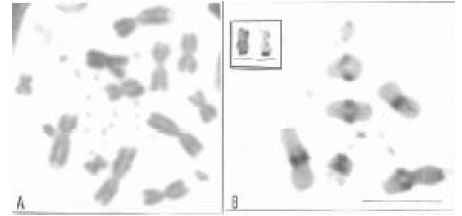
Fig. 2. Liolaemus azarai (2n = 34) A) Metafase intestinal coloreada con tinción convencional. B) Patrón de bandas C en diploteno de macho. En recuadro: par 2 de macrocromosomas con RON.
FAMILIA TROPIDURIDAE
Tropidurus torquatus y T. spinulosus comparten el cariotipo básico típico del género: 2n = 36 (12 M
+ 24 m) y un NF de 48 (Beçak et al. 1972, Navarro et al. 1990, Kasahara et al. 1996) (Fig. 3A). En Tropidurus, el patrón de bandas C se caracteriza por una pequeña cantidad de heterocromatina constitutiva
en algunos cromosomas (Fig. 3D). En T. torquatus el RON se ubica en un par de
microcromosomas, localización típica de las especies del grupo torquatus (Navarro et al. 1990, Kasahara et al. 1996) mientras que en T. spinulosus el par 6 de macrocromosomas es portador de los genes
ribosomales, carácter compartido con las especies del grupo nanuzae (Kasahara et al. 1987, Navarro et
al. 1990, Pellegrino et al. 1994, Kasahara et al. 1996) (Fig. 3E y F)
En T. torquatus se observa variación geográfica en los patrones de distribución de la heterocromatina constitutiva y número de RONs. Así, en una población de Corrientes los telómeros de los macrocromosomas son heterocromáticos y un par de microcromosomas porta RONs mientras que en poblaciones de Brasil se reconocieron dos patrones diferentes de bandas C en los microcromosomas y de uno a cuatro organizadores nucleolares activos (Kasahara et al. 1996, Navarro et al. 1990)
En el género Tropidurus, se describió la presencia de cromosomas sexuales XX/XY, como en T.torquatus, que involucra un par de microcromosmas (Fig. 3B) y sistemas complejos X1X2Y/ X1X1X2X2y XXAA/XAY (Kasahara et al. 1987, 1996).
Los patrones de bandas R en especies del grupo torquatus permitieron la identificación de los cromosomas homólogos (Yonenaga-Yassuda et al. 1988, Kasahara et al. 1996).
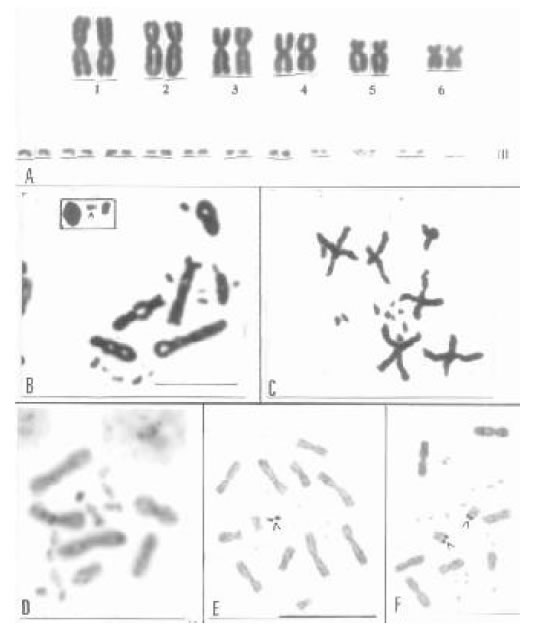
Fig. 3. Tropidurus (2n = 36). A) Cariotipo de Tropidurus torquatus. B) meiosis de macho de T. torquatus mostrando en el recuadro el bivalente sexual asimétrico. C) Metafase II de macho de T. torquatus. D) Patrón de bandas C en diploteno de macho de T. etheridgei. E) Metafase intestinal de T. torquatus con los organizadores nucleolares en un par de microcromosomas. F) Metafase parcial de T. spinulosus con RONs en el par 6 de macrocromosomas.
FAMILIA TEIIDAE
Ameiva ameiva presenta un 2n = 50 (26 M + 24 m), con todos los macrocromosomas acrocéntricos
(Gorman 1970, Peccinini- Seale y Almeida 1986). Con bandeo C se determinó que la heterocromatina
constitutiva se localiza en la región pericentromérica de algunos cromosomas. Se observó variabilidad
interpoblacional en el número y localización de RONs que involucra a 6 pares de
macrocromosomas y a uno de microcromosomas (Peccinini- Seale y Almeida 1986).
Cnemidophorus lacertoides tiene un 2n = 50 y una fórmula cariotípica 26 M + 24 m, con macrocromosomas acrocéntricos, excepto el par 3 que es submetacéntrico. Presenta una constricción secundaria en el primer par de macrocromosomas (Cole et al. 1979).
Cnemidophorus ocellifer presenta un cariotipo especie-específico, tanto en el número diploide como fundamental y el par cromosómico portador de RON que permiten diferenciarlo de las demás especies del grupo lemniscatus (Hernando, en prensa).
El cariotipo de Teius teyou se caracteriza por 2n = 54 cromosomas que disminuyen gradualmente de tamaño, sin clara distinción de macro y microcromosomas. Los genes ribosomales se ubican en dos pares cromosomas telocéntricos (Gorman 1970, Hernando 1994) (Fig. 4A- C). Estas características del cariotipo también se identificaron en T. oculatus.
Tupinambis merianae posee 2n = 38 (10 M + 28 m), con macrocromosomas metacéntricos, excepto el segundo par que es submetacéntrico y portador de una constricción secundaria distal, sitio de RON. Los microcromosomas son acrocéntricos. No se distinguen cromosomas sexuales heteromórficos (Hernando y Quintana 1999).
Los Teiidae, conocidos informalmente como macroteidos, muestran un amplio rango de números diploides que varían desde 34 a 56 cromosomas. En base a caracteres morfológicos se reconocen dos subfamilias: Tupinambinae y Teiinae que coinciden con los grupos denominados Dracaenay Ameiva, respectivamente, propuestos por Gorman (1970) teniendo en cuenta la evidente diferenciación cariotípica entre ambos.
El grupo Dracaena incluye los géneros Dracaena, Tupinambis, Callopistes y Crocodilurus. Presenta 2n = 34 a 38, con 12 macrocromosomas metacéntricos y submetacéntricos y microcromosomas que varían entre 22 a 26, compartiendo el par 2 que porta una constricción secundaria. Los cariotipos de los géneros se diferencian en la morfología y el tamaño del par 6. Fisiones céntricas e inversiones pericéntricas explicarían estas diferencias (Gorman 1970).
El grupo Ameiva, integrado por Teius, Dicrodon, Ameiva, Cnemidophorus, Kentropyx y el géneroAspidoscelis recientemente reconocido, son también llamados informalmente “cnemidoforines”. Muestran cariotipos con número diploide de 46 a 56 y morfología acrocéntrica o subtelocéntrica en la mayoría de los macrocromosomas.
Con respecto a la evolución cromosómica en esta familia, recientemente Reeder et al. (2002) plantearon que los macroteiidos del grupo Dracaena exhiben la condición primitiva. Para Ameiva, Aspidoscelis, Cnemidophorus y Kentropyx dicha condición es el cariotipo frecuentemente observado en estos géneros: 2n = 50, 26 M + 24 m, con macrocromosomas acrocéntricos y subtelocéntricos y una constricción secundaria ubicada en el par 1. Este complemento pudo derivar del cariotipo básico del grupo Dracaena por fisiones céntricas de los macrocrocromosomas, aunque también otros mecanismos involucrados serian las inversiones pericéntricas y la adición de heterocromatina constitutiva.
Dicrodon y Teius, son considerados géneros basales de cnemidoforines. En el primero, con macrocromosomas acrocéntricos, las fisiones pudieron ocurrir luego de compartir un ancestro común con Tupinambis mientras que los macrocromosomas bibraquiados de Teius representarían cromosomas ancestrales o bien nuevas fusiones céntricas.
Otro aspecto sobresaliente de los Teiidae es la presencia de especies unisexuales diploides y triploides originadas por hibridación entre diferentes especies bisexuales (ver revisión de Reeder et al. 2002) La mayoría de estos taxa partenogenéticos pertenecen al género Aspidoscelis (12 especies y complejos de especies) pero también se registran en Kentropyx (1 especie), Cnemidophorus (3 especies) y Teius (1 especie).
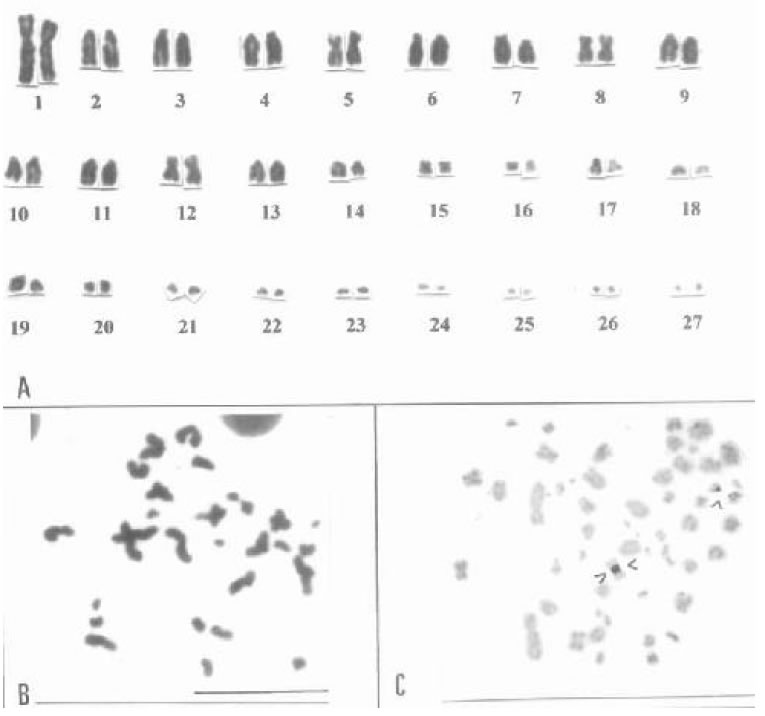
Fig. 4. Teius teyou (2n = 54). A) Cariotipo. B) Metafase II de macho. C) Metafase de médula ósea mostrando organizadores nucleolares, dos de ellos asociados.
FAMILIA GYMNOPHTHALMIDAE
Observaciones preliminares del cariotipo de Cercosaura schreibersii schreibersii mostraron un alto
número diploide, un par de cromosomas portadores de RON y polimorfismo en un par de
macrocromosomas dado posiblemente por una fisión e inversión pericéntrica (Hernando, datos no
publicados)
Los análisis citogenéticos por medio de diversas técnicas de coloración diferencial muestran una notable variabilidad cromosómica en la familia Gymnophthalmidae, posiblemente la mayor conocida para los Squamata. Los hallazgos que avalan este punto de vista son los cariotipos especieespecíficos, el amplio rango de números diploides (2n = 32 a 64); variación intraespecífica en número, morfología y tamaño de cromosomas B; diferencias en el número y localización del RON en especies estrechamente relacionadas; polimorfismos cromosómicos que involucran inversiones pericéntricas, especies unisexuales diploides y triploides y diversos mecanismos de determinación del sexo (Cole et al., 1990; Yonenaga- Yassuda et al. 1995, 1996; Yonenaga- Yassuda y Rodrigues 1999; Pellegrino et al. 1999 a y b, 2003).
FAMILIA SCINCIDAE
M. frenata tiene un 2n = 30) (16 M + 14 m) (Hernando y Alvarez, 1990) (Fig. 5A- B) y el cariotipo
presenta las características conocidas como típicas para los scíncidos: número diploide con 28, 30 o 32
cromosomas de los cuales 4 pares son macrocromosomas bibraquiados y 4 o 5 pares de cromosomas
de tamaño medio exhiben morfologías diversas (Olmo et al. 1995)
El cariotipo de M. dorsivittata se diferencia de aquel de M. frenata por la presencia de un par de microcromosomas, pero en ambas especies los organizadores nucleolares están ubicados en un par de macrocromosomas (Hernando, en prensa)
Mabuya es el único género de scíncido presente en América del Sur y hasta el momento se conocen también los cariotipos de M. mabouya (2n = 30/31) (Becak et al. 1972), M. caissara y M. macrorhyncha (2n = 32) (Syllos- Cólus y Ferrari 1988)
En los scíncidos, los reordenamientos incluyen inversiones, translocaciones y pérdida de microcromosomas siendo escasas las descripciones de mutaciones robertsonianas. Los cromosomas sexuales son raros aunque se describieron los sistemas XX/XY y X1X1X2X2/X1X2Y en diferentes poblaciones en Scincella lateralis (Wright 1973) y en Scincus scincus las hembras poseen RONs homomórficas y los machos en condición heteromórfica (Caputo et al. 1994).
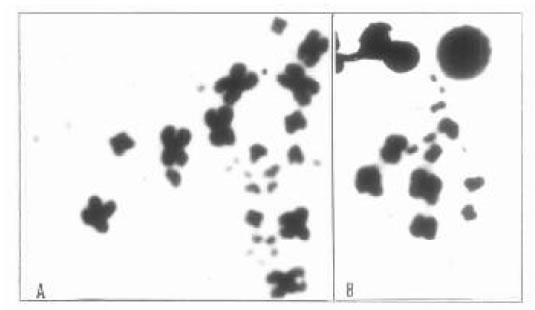
Fig. 5. Mabuya frenata (2n = 30). A) Metafase intestinal coloreada con coloración convencional. B) Metafase II de testículo de macho.
FAMILIA GEKKONIDAE
Hemidactylus mabouia es una especie nativa del oeste de África, actualmente con amplia dispersión
en América del Sur. En varias poblaciones de Brasil y Trinidad, el cariotipo descripto fue 2n = 42 con
cromosomas metacéntricos, submetaéntricos y acrocéntricos que disminuyen gradualmente de tamaño,
sin clara distinción entre macros y microcromosomas (Beçak et al. 1972, MacBee et al. 1987,
Pellegrino et al. 1995). No se identificaron cromosomas sexuales. Las regiones heterocromáticas se
ubican en los telómeros de la mayoría de los cromosomas y un par de cromosomas acrocéntricos es
portador de los genes ribosomales; el patrón de bandas R permitió establecer los pares cromosómicos
homólogos (Pellegrino et al. 1995).
Los Gekkonidae, de distribución cosmopolita, muestra un amplio rango de números diploides que varía entre 2n = 16 (NF = 32) y 2n = 48 (NF = 50), aunque los números cromosómicos más frecuentes son 38 a 42 (Olmo 1986). La característica comúnmente establecida en los cariotipos de los gecos es que la mayoría de los cromosomas son acrocéntricos o subtelocéntricos que disminuyen gradualmente de tamaño, condición considerada como ancestral para la familia. En las formas morfológicamente derivadas los números cromosómicos son más bajos y aumentan los cromosomas bibraquiados por lo que las fusiones céntricas habrían tenido un papel importante en la evolución cromosómica de estos saurios (King y Rofe 1976).
En las especies con cromosomas sexuales, el sistema es ZZ/ZW (Olmo 1986), aunque en Gekko y Gonatodes se describió del tipo XX/XY (Solleder y Schmid 1984, Mac Bee et al. 1987). Moritz (1990) sugiere que los cromosomas sexuales tienen un origen reciente debido a que están caracterizados por una limitada diferenciación, variación intra e interpoblacional y una esporádica distribución entre los taxa de la familia.
Entre los geckos existen unas ocho especies unisexuales cuyo origen híbrido se demostró de manera inequívoca en los casos estudiados (Ineich 1992).
FAMILIA AMPHISBAENIDAE
Leposternon microcephalum tiene un cariotipo 2n = 34 (12 M + 22 m) con 6 pares de
macrocromosomas metacéntricos y submetacéntricos y 11 pares de microcromosomes acrocéntricos
(Huang et al. 1967; Hernando en prensa) (Fig. 6A).
Amphisbaena angustifrons, A. hiata y A. darwini heterozonata comparten un cariotipo 2n = 30 (12 M + 18 m) con macrocrocromosomas bibraquiados y microcromosomas en su mayoría también con esta morfología (Huang et al. 1967, Hernando, en prensa).
Amphisbaena mertensi se caracteriza por un 2n = 40 (18 M + 22 m). El cariotipo muestra 6 macrocromosomas bibraquiados y 12 acrocéntricos, y 11 pares de microcromosomes (Hernando, en prensa).
Anops kingi presenta un cariotipo 2n = 26 (12 M + 14m), con 6 pares de macrocromosomas metacéntricos y submetacéntricos (Huang y Gans 1971). Este número cromosómico es el más bajo conocido entre los anfisbénidos.
La aplicación de tinción argéntica mostró una localización especie - específica de RON, lo cual que permite diferenciar los taxa con cariotipos similares. En Leposternon microcephalum, A. hiata y A. mertensi un par de macrocromosomas es el sitio de RON (par 3, par 4 y un par acrocéntrico, respectivamente) mientras que en A. darwini heterozonata se observaron múltiples organizadores nucleolares activos (Hernando en prensa) (Fig. 6B-E)
Hasta el momento, se analizaron con coloración convencional sólo el 22 % de las especies reconocidas posiblemente por la falta de ejemplares disponibles debido a los hábitos secretos de los anfisbénidos. A pesar de ello, se pude apreciar una diversidad cromosómica no sólo numérica, con números diploides entre 26 en Anops kingi y 50 cromosomas en Amphisbaena innocens, sino también estructural con números fundamentales entre 42 a 72 (Huang et al. 1967; Huang y Gans 1971), señalando Gans (1978) la particular variación intragenérica en Amphisbaena.
En los anfisbénidos no se describieron mecanismos de determinación del sexo.
Un cariotipo con 12 macrocromosomas metacéntricos y submetacéntricos con 18 o 22 microcromosomas es la condición primitiva, descripta en la mayoría de las formas del Viejo Mundo. Las formas africanas y del Nuevo Mundo muestran una variabilidad cromosómica mayor con números diploides entre 38 a 50. Aunque son escasos datos citogenéticos disponibles, se propuso que los mecanismos involucrados en la evolución cromosómica de los anfisbénidos son las fusiones y fisiones céntricos, pero algunas especies poseen brazos cromosómicos mayores a los que derivarían de un cariotipo 2n = 36 (12 M + 24 m) por lo que complejos reordenamientos estarían involucrados (Huang et al. 1967; Huang y Gans 1971).
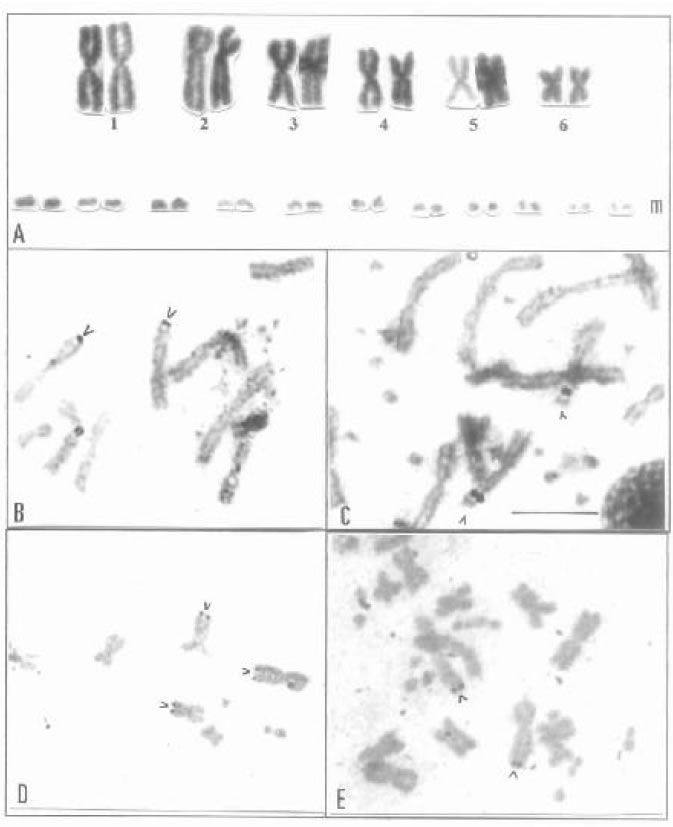
Fig. 6. Amphisbaenidae. A) Cariotipo de Leposternon microcephalum (2n = 34). B) Metafase parcial mostrando un par de macrocromosomas con RONs en L. microcephalum y Amphisbaena hiata (C). D) Metafase parcial A. darwini heterozonata con tres organizadores nucleolares y con dos RONs (E).
FAMILIA ANGUIDAE
Ophiodes intermedius tiene un número diploide de 36 cromosomas, con 12 macrocromosomas y
24 microcromosomas con ambos grupos de cromosomas metacéntricos y sumetacéntricos, sin
cromosomas sexuales heteromórficos (Hernando 2002) (Fig. 7A-C). Este cariotipo es similar al de O. striatus (Beçak et al. 1972).
En esta familia los números diploides varían de 30 a 48 mientras que el rango de números fundamentales (NF) está comprendido entre 34 y 48 (Olmo 1986). La evolución cromosómica en esta familia estaría caracterizada por el aumento del número diploide debido a fisiones céntricas de macrocromosomas a partir de un 2n = 36 (12 M + 24 m) (Gorman 1973).
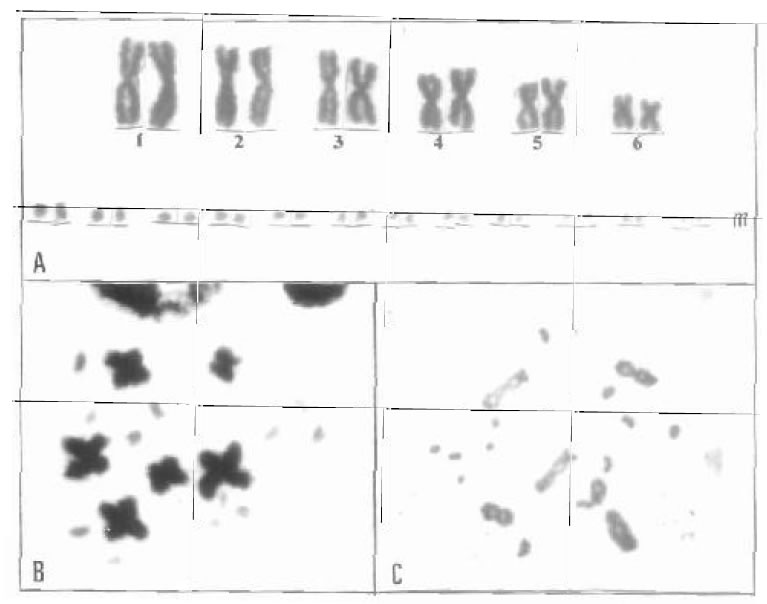
Fig. 7. Ophiodes intermedius (2n = 36). A) Cariotipo. B) Metafase II de macho. C) Diploteno con 18 bivalentes.
Conclusiones
De las 30 especies reconocidas para el litoral fluvial argentino se registran datos cromosómicos para el 66 % de esta fauna. Los resultados muestran que algunos grupos como los Gymnophthalmidae y Amphisbaenidae son escamados interesantes para estudiar modelos de evolución cromosómica.
Los análisis citogenéticos realizados en poblaciones de saurios y anfisbénidos de la citada región están referidos al número y morfología de los cromosomas, identificación de los patrones de heterocromatina constitutiva y regiones organizadoras del nucleolo. Las características cromosómicas demostraron ser una herramienta diagnóstica importante para distinguir especies, proponer los reordenamientos involucrados en la evolución cromosómica de algunos grupos o avalar modelos de especiación.
Sin embargo, estos estudios no se han realizado con igual intensidad en los diferentes géneros y familias. Por ello, puede considerarse que el conocimiento actual es aún fragmentario. Es necesario analizar en particular algunos géneros como Stenocercus o Kentropyx que no registran antecedentes, intensificar los estudios a través de técnicas de bandeos de alta resolución para obtener información sobre la composición y características moleculares de los cromosomas. Los datos obtenidos permitirám realizar exhaustivas comparaciones, por ejemplo entre especies de un género o de diferentes familias con cariotipos similares, a los efectos de reconstruir relaciones taxonómicas y filogenéticas contrastando con hipótesis basadas en evidencias morfológicas, inmunológicas o moleculares.
Bibliografía
Aiassa D., Gorla, N., Avila, L. y Martori, R. 1998. Cariotipo de Liolaemus darwinii (Bell), Squamata: Tropiduridae. FACENA, 15: 137-144
Aiassa D., Gorla, N., Avila L. y Martori, R. 1999. Cariotipo de Liolaemus saxatilis (Squamata: Tropiduridae): definición y comparación con otros taxones del grupo chiliensis. Rev. Esp. Herp., 12: 63-67
Alvarez, B., Aguirre, R, Céspedez, J., Hernando, A. y Tedesco, M.E. 2002. Atlas de Anfibios y Reptiles de las provincias de Corrientes, Chaco y Formosa (Argentina). I. Anuros, Cecílidos, Saurios, Anfisbénidos y Serpientes. Editorial Universitaria de la Universidad Nacional del Nordeste (EUDENE), 156 pp.
Beçak M.L., Beçak, W. y Denaro, L. 1972. Chromosome polymorphism, geographical variation and karytoypes in Sauria. Caryologia 25: 313 – 326
Bertolotto C.E.V., Pellegrino, K.C.M., Rodrigues, M.T. y Yonenaga- Yassuda, Y. 2002. Comparative cytogenetics and supernumerary chromosomes in the Brazilian lizard genus Enyalius (Squamata, Polychrotidae). Hereditas 136: 51 -57
Bertolotto C.E.V., Rodrigues, M.T., Skuk, G. y Yonenaga- Yassuda, Y. 1996. Comparative cytogenetic analysis with differential staining in three species of Liolaemus (Squamata, Tropiduridae). Hereditas 125: 257-264
Bertolotto C.E.V., Rodrigues. M.T. y Yonenaga- Yassuda. Y. 2001. Banding patterns, multiple sex chromosome system and localization of telomeric (TTAGGG)(n) sequences by FISH on two species of Polychrus (Squamata, Polychrotidae). Caryologia 54: 217- 226
Caputo, V., Odierna, G. y Aprea, G. 1994. A chromosomal study of Eumeces and Scincus, primitive members of the Scincidae (Reptilia: Squamata). Boll. Zool. 61: 155- 162.
Cole, C. J., Dessauer, H.C., Townsend, C.R. y Arnold, M.G. 1990. Unisexual lizard of the genus Gymnophthalmus (Reptilia: Teiidae) in the neotropics: genetics, origin and systematics.Am. Mus. Novitates 2994: 1- 29
Cole C.J., McCoy, C. y Achaval, F. 1979. Karyotype of a South American teiid lizard, Cnemidophorus lacertoides. Am. Mus. Novit. 2671: 1-5
Coyne, J.A. y Orr, H.A. 1998. The evolutinary genetics of especiation. Phil. Trans. R. Soc. Lond. B. 353: 287-305
Gans, C. 1978. The characteristics and affinities of the Amphisbaenia. Trasn. zool. Soc. Lond. 34: 347- 416
Gorman, G.C. 1970. Chromosomes and the systematics of the family Teiidae (Sauria, Reptilia). Copeia (2): 230-245
Gorman, G.C. 1973. The chromosomes of the Reptilia, a cytotaxonomic interpretation. En Chiarelli, A.B. & Capanna, E. (eds.). Cytotaxonomy and Vertebrates evolution. Pp. 349-424. Academic Press. London.
Gorman, G.C., Atkins, L. y Holzinger, T. 1967. New karyotypic data on 15 genera of lizards in the family Iguanidae, with a discussion of taxonomic and cytological implications. Cytogenetics 6: 286 –299
Hernando, A. 1994. Cariotipo y región organizadora del nucleolo en Teius teyou (Daudin, 1802) (Squamata: Teiidae). Cuadernos de Herpetología, 8 (1): 87-89
Hernando, A. 1995. Nota sobre el cariotipo de Anisolepis longicauda (Boulenger, 1981) (Polychrotidae) de la Isla Yacyretá, Paraguay. FACENA 11: 113- 114
Hernando, A. 1995. Cariotipo y organizador nucleolar de Polychrus acutirostris Spix (Polychrotidae). FACENA, 11: 93- 97
Hernando, A. 2002. Caracterización cromosómica de Ophiodes intermedius (Sauria:Anguidae). FACENA 18: 31-34
Hernando, A. 2003. Karyotype, constitutive heterochromatin and nucleolus organizer regions in two species of Liolaemus (Squamata, Tropiduridae). Caryologia 56 (3):269- 273
Hernando, A y Alvarez, B. 1990. Cariotipo de Mabuya frenata (Sauria, Scincidae). FACENA 8: 53- 59
Hernando, A. y Quintana, M. 1999. Estudios cromosómicos en Tupinambis merianae y T. rufescens (Squamata: Teiidae). V Congreso Latinoamericano de Herpetología. Resúmen: 70
Huang, C.C., Clark, H.F. y Gans, C. 1967. Karyological studies on fifteen forms of amphisbaenians (Amphisbaenia, Reptilia). Chromosoma 22: 1- 15
Huang, C.C., y Gans, C. 1971. The chromosomes of 14 species of amphisbaenians (Amphisbaenia, Reptilia). Cytogenetics 10: 10- 22
Ineich, I. 1992. La parthenogenese chez les Gekkonidae (Reptilia, Lacertilia): origine et evolution. Bull. Soc. zool. Fr. 117 (3): 253- 266.
Iturra, P., Veloso, A., Espejo, P. y Navarro, J. 1994. Karyotypic and meiotic evidence for a Robertsonian chromosome polymorphism in the lizard Liolaemus fuscus (Tropiduridae, Sauria). Rev. Brasil. Genet. 17 (2): 171-174
Kasahara, S., Pellegrino, K.C.M., Rodrigues, M.T. y Yonenaga- Yassuda, Y. 1996. Comparative cytogenetic studies of eleven species of the Tropidurus torquatus group (Sauria Tropiduridae), with banding patterns. Hereditas 125: 37- 46
Kasahara, S., Yonenaga-Yassuda, Y. y Rodrigues, M.T. 1987. Karyotype and evolution of the Tropidurus nanuzae species group (Sauria, Iguanidae). Rev Brasil. Genet. X, 2: 185- 197
King, M. y Rofe, R. 1976. Karyotypic variation in the Australian gekko Phyllodactylus marmoratus (Gray) (Gekkonidae: Reptilia). Chromosoma 54: 75-87.
Lamborot, M. 1991. Karyotypic variation among populations of Liolaemus monticola (Tropiduridae) separated by riverine barriers in the Andean range. Copeia (4): 1044-1059.
Lamborot, M. y Alvarez-Sarret, E. 1989. Karyotypic characterization of some Liolaemus lizards in Chile (Iguanidae). Genoma, 32: 393-403
Mac Bee, K., Bickman, J.W. y Dixon, J. 1987. Male heterogamety and chromosomal variation in Caribbean geckos. J. Herpetol. 21 (1): 68- 71
Moritz, C. 1990. Patterns and processes of sex chromosome evolution in gekkonid lizards (Sauria: Reptilia) In: Olmo, E. (ed.) Cytogenetics of Amphibians and Reptiles, Birkhäuser Verlag Basel. pp 205 - 220.
Navarro, J. 1992. Cariotipos de trece especies de lagartijas del noroeste argentino de los grupos Liolaemus, Eulaemus y Ortholaemus. Acta zool. Lilloana 41: 225- 230
Navarro Barón, J., Iturra, P. y Hernando, A. 1990. Estudios cromosómicos en una población de Tropidurus torquatus (Sauria, Iguanidae) de la provincia de Corrientes, Argentina. Acta Zoologica Lilloana 41: 231- 234
Olmo, E. 1986. Reptilia, pp. 1- 100, in John, B. (ed.), Animal Cytogenetics. Vol. 4 Chordata 3. Berlin Gebrüder Borntraeger
Olmo, E., Capriglione, T., Odierna, G., Caputo, V. y Canapa, A. 1995. Results and perspectives in the study of scincomorph karyology. Scientia Herpetologica: 53- 67
Peccinini, D. 1970. Variaçao nos cromossomos do lagarto Polychrus marmoratus (Sauria, Iguanidae) de diferentes localidades. Rev. Bras. Genet., 30: 1-4
Peccinini-Seale, D. 1981. New developments in vertebrate cytotaxonomy. IV. Cytogenetic studies in reptiles. Genetica 56: 123- 148
Peccinini-Seale, D. y Almeida, T. 1986. Chromosomal variation, nucleolar organizers and constitutive heterochromatin in the genus Ameiva and Cnemidophorus (Sauria: Teiidae). Caryologia 39 (3-4): 227- 237
Pellegrino, K.C.M., Araripe Sucupira, M.C., Kasahara, S., Rodrigues, M.T. y Yonenaga- Yassuda, Y. 1995. C- and Rbanding patterns and nucleolus organizer regions in the karyotype of Hemidactylus mabuoia (Sauria, Gekkonidae). Brazilian Journal of Genetics 18: (4) 527- 531
Pellegrino, K.C.M., Bertolotto, C.E.V., Rodrigues, M.T. y Yonenaga-Yassuda, Y. 1999. Banding patterns, heteromorphic sex chromosomes and Ag-stained NORs alter pachytene stage in the meiosis of the Brazilian lizard Urostrophus vautieri (Squamata, Polychrotidae). Caryologia 52: 21- 26
Pellegrino, K.C.M., Rodrigues, M.T. y Yonenaga-Yassuda, Y. 1999a. Chromosomal evolution in Brazilian lizards of genus Leposoma (Squamata, Gymnophthalmidae) from Amazon and Atlantic rain forest: evidences based on Rbanding and FISH of telomeric sequences. Hereditas 131 (1): 15-21
Pellegrino, K.C.M., Rodrigues, M.T. y Yonenaga-Yassuda, Y. 1999b. Chromosomal polymorphism due to occurrence of supernumerary chromosomes and pericentric inversions in the eyelid-less microteiid lizard Nothobachia ablephara (Squamata, Gymnophthalmidae). Chrom Res. 7 (4): 247-254
Pellegrino, K.C.M., Rodrigues, M.T. y Yonenaga-Yassuda, Y. 2003. Triploid Karyotype of Leposoma percarinatum (Squamata, Gymnophthalmidae). J. Herpetol. 37 (1): 197- 199
Pellegrino, K. C. M.; Yonenaga-Yassuda, Y. y Rodrigues, M. T. 1994. Cytogenetic studies in six species of Tropiduridae (Sauria). Rev. Brasil. Genet. 17 (4): 401-408
Pinna-Senn, E., Di Tada, I.E. y Lisanti, J.A. 1987. Polymorphism of the microchromosomes and the nucleolar organizer region in Pristidactylus achalensis (Sauria, Iganidae). Herpetologica 43 (1): 120- 127
Reeder, T.W., Cole, Ch.J. y Dessauer, H.C. 2002. Phylogenetic Relationships of Whiptail Lizards of the Genus Cnemidophorus (Squamata: Teiidae): A Test of Monophyly, Reevaluation of Karyotypic Evolution, and Review of Hybrid Origins. American Museum Novitates 3365: 1- 61
Rieseberg, L.H. 2001. Chromosomal rearrangements and speciation. Trends Ecol. Evol. (16) 7: 351-358
Sites, J.W. Jr y Reed, K. 1994. Chromosomal evolution, speciation, and systematics: some relevant issues. Herpetologica 50 (2): 237 –249
Solleder, E. y Schmid, M. 1984. XX/XY- Sex chromosomes in Gekko gecko (Sauria, Reptilia). Amphibia:Reptilia 5: 339- 345.
Syllos Cólus, I.M. de y Ferrari, I. 1988. Mitotic and meiotic chromosomes of Mabuya (Scincidae: Reptilia). Genetica: 77: 105- 111
Wright, J. 1973. Evolution of the X1X2Y sex chromosome mechanism in the scincid lizard Scincella laterale (Say). Chromosoma (Berl.) 43: 101- 108.
Yonenaga-Yassuda, Y.; Kasahara, S.; Chu, T.H. y Rodrigues, M.T. 1988. High-resolution RBG-banding pattern in the genus Tropidurus (Sauria, Iguanidae). Cytogenet. Cell Genet., 48: 68-71
Yonenaga-Yassuda, Y., Mori, L., Chu, T.H. y Rodrigues, M.T. 1996. Chromosomal banding patterns in the eyelidless microteiid radiation: Procellosaurinus and Vanzosaura (Squamata, Gymnophthalmidae) Cytogenet. Cell genet. 74: 203- 210
Yonenaga-Yassuda, Y. y Rodrigues, M.T. 1999. Supernumerary chromosome variation, heteromorphic sex chromosomes and banding patterns in microteiid lizards of the genus Micrablepharus (Squamata, Gymnophthalmidae). Chrom. Res. 7 (1): 21-29
Yonenaga-Yassuda, Y., Vanzolini, P.E., Rodrigues, M.T. y de Carvalho, C.M. 1995. Chromosomal banding patterns in the unisexual microteiid Gymnophthalmus underwoodi and two related sibling species (Gymnophthalmidae, Sauria) Cytogenet. Cell genet. 70: 29- 34