Diversidad y conservación de anuros en ecosistemas agrícolas de Argentina: implicancias en el control biológico de plagas
Paola M. PELTZER 1 ; Rafael C. LAJMANOVICH 2 ; Andrés M. ATTADEMO 2 ; Walter CEJAS 3
1 Instituto Nacional de Limnología (INALI-CONICET-UNL). José Macias 1933. (3016) Santo Tomé- Santa Fe, Argentina E-mail: paolapeltzer@hotmail.comAbstract: DIVERSITY AND CONSERVATION OF ANURAN IN AGRICULTURAL ECOSYSTEMS OF ARGENTINA: IMPLICATION IN THE BIOLOGICAL CONTROL OF PLAGUES.- The conversion of forest to agricultural land is occurring at rapid rates in many Neotropical areas. These land-cover trends have spurred research to investigate the role that agroecosystems play in providing habitat for Neotropical organisms and in the conservation of biodiversity. In the center-east of Argentina, traditional agriculture was replaced by a more specialized agriculture aimed at large scale production with glyphosate-tolerant (GT)-soybean (Glycine max L.) as the dominant crop. This new agriculture has led to the expansion of cultivated areas, thus exerting an increasing pressure on uncultivated portions of the land and wildlife survival. We examined the anuran amphibian diversity of 31 ponds (30 located on the border of soybean cropland and 1 within a protected forest) in mid-western Entre Ríos Province (Argentina). Moreover, we examined the diet composition of anuran in soybean of the Córdoba and Entre Ríos Provinces of Argentina, investigating their potential as biological control agents of herbivores species. The ponds surrounded by soybean croplands varied in their capacity to support anuran species. Management of anurans on agroecosystems will require defining high-quality habitat for individual species or group of species, followed by efforts to retain or restore these aquatic habitat. The maintenance of shore vegetation of ponds and hedgerows may increase the number of species and diversity of anurans within agricultural landscapes. Thus, the variety of arthropods they consumed suggests that anuran populations could be important biological control factors of soybean arthropods. Finally, a more diversified system of cultivations could contain certain resources for the natural enemies, provided by the diversity of plants in the field borders and environmental heterogeneity.-
Key words: Amphibians - Diversity - Conservation - Agro-ecosystems - Argentina
Palabras clave: Anfibios - Diversidad - Conservación - Agro-ecosistemas - Argentina
Introducción
Las actuales tendencias de las actividades agrícolas implican la simplificación del paisaje y una reducción de la diversidad biológica, que alcanzan una forma extrema con la expansión de los monocultivos. Las consecuencias de estas acciones, son una producción artificial que requiere de una intervención humana constante a través de una permanente utilización de insumos químicos y tecnologías mecanizadas, que si bien aumentan los rendimientos productivos, resultan en una cantidad de costos sociales y ambientales indeseables (Altieri, 1987).
En la Argentina el complejo oleaginoso es el principal sustento de la economía nacional y el primer sector agrícola, con ventas anuales de más de 5.000 millones de dólares. Actualmente, el cultivo de mayor expansión en el país es la soja transgénica (Glycine max. (L) Merril), con un total de aproximadamente 14,23 millones de hectáreas sembradas durante la campaña 2003-2004 (Kippes, 2004). En el territorio nacional, la actividad sojera se centra en dos grandes regiones (Fig. 1), primaria y secundaria (Hin et al., 2001). La región primaria comprende las provincias de Buenos Aires, Córdoba, Santa Fe, y este de Entre Ríos, concentrando el 90% de la producción total del país. La segunda se extiende hacia las provincias de Salta, Tucumán y Santiago del Estero. En estas zonas predomina la matriz agrícola sobre los remanentes boscosos que difieren en su grado de intervención antrópica y sucesión vegetal (Bertonati y Corcuera, 2000).

Fig. 1. Principales regiones sojeras de Argentina.
El incremento de los problemas provocados por las plagas agrícolas está relacionado con la expansión de los monocultivos, a expensas de la diversidad vegetal, declinando con ello la diversidad del hábitat local (Altieri y Letourneau, 1982, Flint y Roberts, 1988). En este sentido, algunos investigadores han advertido reiteradamente sobre la extrema vulnerabilidad asociada con la uniformidad genética de los monocultivos (Fowler y Mooney, 1990). En nuestro país, una gran cantidad deagroquímicos, como glifosato, cipermetrina y endosulfán, son utilizados en los sistemas de producción de soja. Aunque estos biocidas han impulsado los rendimientos de los cultivos y han sido valorados por su rápida acción y fácil aplicación (CASAFE, 1999), sus efectos ambientales no deseados están provocando una disminución de la sustentabilidad de la agricultura. Estos compuestos pueden tener consecuencias sobre la salud humana, efectos residuales e impactos nocivos sobre la fauna silvestre (Lenardón y Enrique, 1998; Lenardón et al., 1999; Izaguirre et al., 2000; Lajmanovich et al., 2002; Lajmanovich et al., 2003 a-b). Asimismo, al aumentarse el uso del control químico, al suprimir la efectividad del control biológico, trae consigo el aumento de resistencia o resurgimiento de nuevas plagas (Herzog y Funderburk, 1986).
La explotación de los sinergismos en situaciones reales involucra el diseño y manejo del agroecosistema y requiere del entendimiento de las numerosas relaciones entre suelos, micro-organismos, plantas, artrópodos herbívoros y enemigos naturales (Altieri, 1991). Es por esta razón, que el conocimiento de los organismos que interactúan en los ecosistemas agrícolas tiene un gran interés para los programas de manejo integrado y agricultura sustentable, ya que constituye un motivo importante del por qué hacer un uso racional del suelo y de los productos químicos (Hilje y Hanson, 1998). En este sentido, las investigaciones agronómicas han ayudado a reducir el uso de insumos químicos innecesarios (Altieri, 1992; Aragón et al. 1998), no obstante, los avances sobre cuestiones ambientales, uso y conservación de los recursos naturales, son más recientes (Bertonati y Corcuera,2000). Un sector muy avanzado es el del control integrado de plagas, cuyos resultados son notablemente favorables (De Bach, 1964; Hokkanen y Pimentel, 1989). Cabe subrayar que el fomento de los enemigos naturales y del uso de las tácticas del manejo integrado, se está llevando a cabo en Estados Unidos y Europa con creciente interés (Williamson, 1998) y de incrementarse en la Argentina, favorecerían a expandir los mercados internacionales de exportación de las producciones regionales, debido a que se valora cada vez más a los productos que se obtienen optimizando la utilización de agroquímicos. Por lo general, distintos autores sugieren como enemigos naturales de plagas agrícolas a bacterias, hongos, virus y parasitoides e invertebrados predadores (Saini, 2001), sin embargo, es insuficiente la información sobre el rol que ejercen los vertebrados en los cultivos (Hyatt y Humphrey, 1995). En este contexto, el control biológico que ejercen los anfibios anuros sobre las plagas es una variable poco conocida en nuestro país.
Por todo lo antes expuesto, los objetivos del presente trabajo fueron 1. Evaluar la diversidad y composición de anfibios anuros en lagunas agrícolas, 2. Analizar el posible control biológico que ejercen los anfibios sobre los artrópodos perjudiciales de los cultivos de soja y 3. Proponer estrategias o herramientas para la conservación de estos vertebrados en los agroecosistemas.
Estudios previos, demostraron que los ecosistemas agrícolas sustentan una gran abundancia de anfibios anuros, pero con un escaso número de especies (Peltzer et al., 2004a). Además, se verificó la hipótesis de que los anfibios son efectivos controladores naturales de diversos artrópodos (Lajmanovich et al., 2003). Es de destacar la importancia del estudio integral de las actividades agrícolas, como una forma de conocer los diferentes tipos de problemas del ecosistema como ser la reducción del hábitat para diferentes especies silvestres y el uso intensivo de agroquímicos. Estos tipos de estudios son esenciales para obtener soluciones que puedan conllevar una buena relación entre el desarrollo económico con el social y ambiental.
Materiales y métodos
DIVERSIDAD Y COMPOSICIÓN DE LA FAUNA DE ANFIBIOS EN LAGUNAS AGRÍCOLAS
Área de estudio
El muestreo se realizó en el centro-este de la provincia de Entre Ríos (31º 44´S - 60º 31´O) (Fig. 2).
Climáticamente esta región presenta un régimen promedio anual de precipitaciones de 1,000 mm y una temperatura media de 18ºC. En el área confluyen distintas formaciones biogeográficas, aportando una gran heterogeneidad desde el punto de vista florístico y faunístico (Lajmanovich y Peltzer, 2001). Particularmente, están representados bosques fluviales (Distritos de Selvas Mixtas) con fisonomía de la Provincia Paranaense (Dominio Amazónico), bosques de la Provincia del Espinal (Bosque Chaqueño, ecotono de los Distritos del Ñandubay y del Algarrobo) y bosque con especies exóticas (ej. Gleditsia triachantos, Parkinsonia aculeata, Ligustrum lucidum). Zoogeográficamente corresponde al Dominio Subtropical (Subregión Guayano-Brasilera) representado por el Distrito Mesopotámico con una menor influencia del Distrito Pampásico (Ringuelet, 1961).
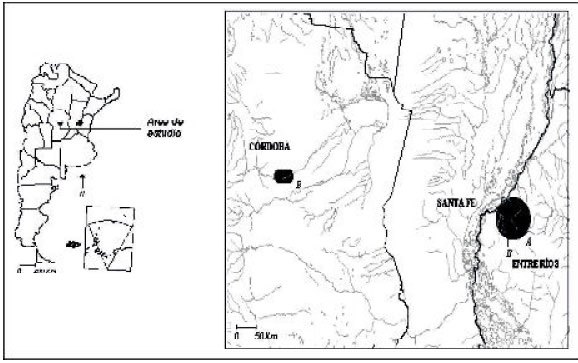
Fig. 2. Localización de las áreas de estudio de (A): Diversidad y composición de anfibios anuros
y (B): Control
biológico sobre plagas de cultivos de soja.
A pesar de esta gran heterogeneidad ambiental, los agroecosistemas cubren la mayor superficie del suelo de Entre Ríos, ocupando aproximadamente el 60% de 2,500 millones de hectáreas del centro-oeste de la provincia, siendo la soja (40%) el principal cultivo, seguido en orden de superficie cultivada, por el maíz y otros cereales (17%). El área restante está representada por remanentes de vegetación nativa que varían en su grado de conectividad y antropización (43%). Es notable destacar como una práctica muy habitual en el área, como así también en las principales regiones sojeras del país, ocupar la mayor superficie del suelo posible, de manera que los bordes de campo (Fig. 3), estructuras conocidas por su función como corredores de fauna, dispersión, aislamiento y barrera contra contaminación de agroquímicos se encuentran limitados en extensión o a pocos campos, o en algunos casos son eliminados con prácticas de fuego (Fig. 4).
Metodología
El muestreo de anuros se realizó durante el período de cultivo de soja desde noviembre de 2002 a marzo de 2003, en coincidencia con la mayor actividad de los anfibios de la región. Se utilizaron imágenes TM-Landsat 7 para seleccionar 31 lagunas agrícolas: 1 localizada dentro de un área natural protegida (Laguna Control: Parque General San Martín) y 30 lagunas ubicadas al borde de cultivos de soja (Fig. 2 A). Para la estimación de diversidad y composición de la fauna de anfibios se realizaron colectas de renacuajos con copo (ver Lajmanovich, 2000) y muestreos nocturnos sobre la base de técnicas estandarizadas (Heyer et al., 1994).
Cada especie de anuro fue categorizada, según sus tipos ecomorfológicos y uso del sub-nicho espacial, en gremios: 1. especies de hábitos terrícolas; 2. hábitos acuáticos y semiacuáticos y 3. hábitos arbóreos (Vallan, 2000). Ejemplares de referencia se encuentran depositados en la colección del Instituto Nacional de Limnología (PL = Peltzer y Lajmanovich - INALI).
Por otra parte, se registraron cinco variables locales: pH, temperatura del aire y del agua, profundidad y un índice de vegetación; conjuntamente con cuatro variables espaciales: área, distancia interlaguna, distancia al sitio control y ancho del borde de campo.
Fig. 3. Borde de campo, mostrando la disposición de la vegetación respecto a las zonas de cultivos.

Fig. 4. Fotografía de un campo de soja donde se observa la eliminación del borde de campo con fuego.
Análisis estadístico
Para la estimación de la diversidad de anuros se utilizó el índice de Shannon (Shannon y Weaver, 1949) y la comparación de este parámetro, entre las lagunas agrícolas y el control se realizó mediante un t test (Hutcheson, 1970). La equitatividad fue calculada según el criterio de Magurran (1987). La similitud faunística fue evaluada con el coeficiente de Medida de Distancia Euclidiana (Dalrymple, 1988). Para asegurar la distribución normal de los datos fueron transformados a logaritmo y se realizaron análisis de Componentes Principales (ACP) y de Correspondencia Canónica (ACC) para establecer cual o cuales fueron las variables que más influyeron en la variación de la diversidad y composición de anfibios. En último lugar, se utilizó un test de proporcionalidad de gremios (Gotelli y Entsminger, 2001).
DIETA DE ANUROS EN AMBIENTES AGRÍCOLAS
Área de estudio
Para el estudio de dieta se seleccionaron dos agroecosistemas ubicados en la región primaria de producción sojera del país, uno en la provincia de Entre Ríos (Departamento Paraná, 31º 44´ 36´´S - 60 19´40´´O) y el otro en Córdoba (Departamento Río Primero, 31º 14´46´´S - 63º 33´8´´O) (Fig. 2B). Climáticamente, el régimen pluviométrico de ambos sitios osciló entre 800 y 100 mmm y una temperatura promedio entre 22º y 24º C (en sentido oeste-este).
Metodología
Para la captura de los especimenes se utilizaron baterías de trampas de caída húmeda siguiendo las técnicas de trampeo propuestas por Corn (1994) y modificada para ambientes agrícolas por Lajmanovich et al. (2003). El muestreo se realizó, cada siete días, entre los meses de noviembre de 2002 y marzo de 2003 durante la campaña de la soja.
Análisis de la dieta
Se seleccionaron para el estudio de dieta, por su abundancia y mayor biomasa, 15 ejemplares de las siguientes especies que se detallan a continuación: Bufo arenarum (Anura: Bufonidae) (longitud rostro-cloacal promedio, LRC = 71,85 ± 22,2 mm; peso promedio, P = 78,35 ± 41 g) y Leptodactylus latinasus (Anura: Leptodactylidae) (LRC = 29,25 ± 4,09 mm; P = 6,58 ± 1,22 g) para el campo de Córdoba; Leptodactylus chaquensis (Anura: Leptodactylidae) (LRC = 53,6 ± 12,5 mm; P = 14,15 ±5,75 g) y Physalaemus albonotatus (Anura: Leptodactylidae) (LRC = 25,3 ± 1,05 mm; P = 1,02 ± 0,7 g) para el campo de Entre Ríos. En total de estudiaron 60 individuos. El análisis de las dietas se basó en la metodología descripta en Lajmanovich (1996); Peltzer y Lajmanovich (2000, 2002). En la identificación de los ítemes alimentarios se empleo un microscopio estereoscópico y las presas fueron determinadas hasta la menor categoría taxonómica posible. La diversidad trófica (H) se calculó siguiendo el criterio de Hurtubia (1973). Para representar la contribución de las categorías taxonómicas en la dieta, se aplicó un índice de importancia relativa (IRI) según Pinkas et al. (1971). Los lotes de individuos utilizados se encuentran depositados en la colección de referencia del Instituto Nacional de Limnología (INALI-CONICET-UNL).
Resultados
DIVERSIDAD DE ANUROS EN LAGUNAS AGRÍCOLAS
Se registraron un total de 23 especies de anuros en el total del área de estudio correspondiendo a cuatro familias: Microhylidae, Bufonidae, Leptodactylidae y Hylidae (Tabla 1, Anexo I). Las especies presentes en el sitio control como en las lagunas agrícolas fueron: Elachistocleis bicolor, Bufo arenarum, B. paracnemis, B. fernandezae, Odontophrynus americanus, Leptodactylus ocellatus, L. chaquensis, L. latinasus,L. mystacinus, L. gracilis, Physalaemus biligonigerus, P. riograndensis, Lysapsus limellus, Hyla nana, H. pulchella, H. sanborni, Scinax nasicus, S. squalirostris y S. acuminatus. Dos especies L. elenae y H. raniceps fueron registradas dentro del sitio control, mientras que Physalaemus albonotatus y Pseudopaludicola falcipes sólo se encontraron en las lagunas agrícolas. Sobre el total de lagunas muestradas, P. albonotatus se registró en el 73%, seguido en orden de ocurrencia por L. latinasus (70 %) y Bufo paracnemis (66,6 %).
La diversidad de especies en las lagunas agrícolas osciló entre 0,30 (AP 20) y 1,14 (AP 27). La equitatividad presentó valores entre 0,90 y 1. Asimismo, el valor de diversidad en la laguna control fue de 1,27 y la equitatividad fue de 0,96 (Fig. 5). El t test mostró diferencias significativas entre la diversidad de cada laguna agrícola contra el control (en todos los casos, t > 3,21; P < 0,001).
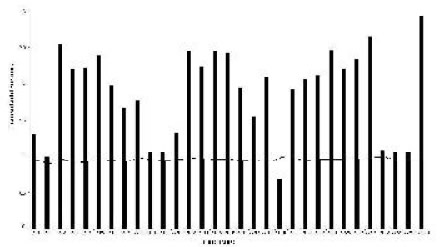
Fig. 5. Diversidad (barra) y equitatividad (línea) de anfibios anuros en lagunas agrícolas (AP) y sitio control.
Similares resultados fueron observados en el análisis de agrupamiento, formándose dos grupos (Fig. 6). El primero (A) reunió a las lagunas agrícolas, diferenciándose dos subgrupos (1 y 2) que presentaron disimilitudes respecto de la diversidad, composición de especies, y variables ambientales y espaciales. El segundo grupo (B) estuvo representado por el sitio control.
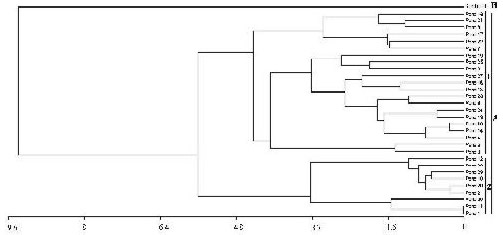
Fig. 6. Fenograma de similitud entre las lagunas agrícolas (Pond) y sítio control.
Respecto del Análisis Componentes Principales (CP), los tres primeros ejes acumularon el 95,61% de la variación total. El CP1 acumuló el 58,35 %, representando un gradiente de diversidad de anuros con el área de las lagunas, ancho del borde de campo y diversidad de la vegetación. El CP2 acumuló al 27,57 % de la variación explicando la variación respecto de la profundidad del cuerpo de agua. El PC3 explicó un 9,69% mostrando un gradiente relacionado con la temperatura del aire. El Análisis de Correspondencia Canónica (ACC) mostró una alta asociación entre los dos grupos de variables, uno formado por la abundancia de cada especie de anuro (variable dependiente) y el restante representado por las variables del ambiente y espaciales (variables independientes) (Tabla 2-Anexo I, Fig. 7 A B).
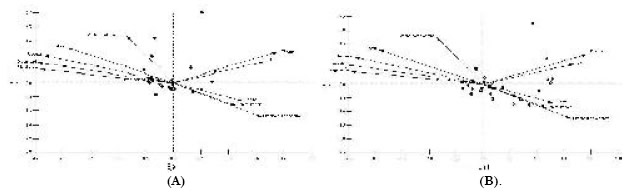
Fig. 7. Diagramas de Correspondencia Canónica. (A) ambientes, (B) especies.
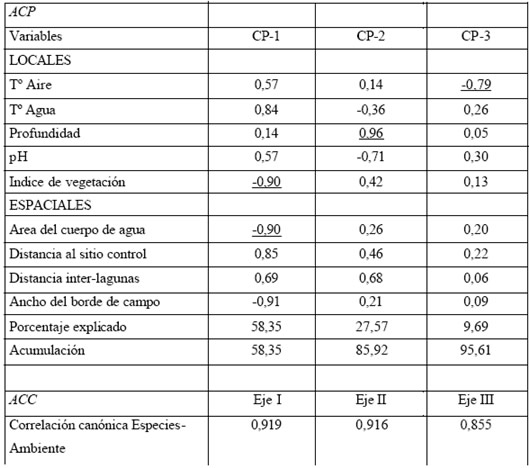
Tabla 2. Análisis de componentes principales (ACP) y correspondencia canónica (ACC).
El número de especies terrestres se incrementó con el aumento del área de las lagunas (Coeficiente de Pearson r : n = 31; r = 0,59; P < 0,01), con la proximidad inter-lagunas (r = 0,82; P < 0,01) y con un aumento en la diversidad de vegetación (r = 0,47; P < 0,01). El número de especies acuáticas se relacionó con la profundidad de las lagunas (r = 0,80; P < 0,01) y la diversidad de la vegetación (r = 0,88; P < 0,01). En cambio, el número de especies arbóreas se correlacionó positivamente con el área de las lagunas (r = 0,88; P < 0,01), ancho del borde de campo (r = 0,69; P < 0,01) y diversidad de vegetación (r = 0,80; P < 0,01). De esta manera, se observó que la proporción de especies (índice CScore) dentro de cada gremio espacial varió intra e inter-lagunas (Fig. 8). El valor del índice fue menor al esperado por chance o al azar, observándose una mayor co-ocurrencia de especies. El gremio terrestre presentó el mayor valor de segregación de especies (40,9), ocurriendo lo contrario con el gremio arbóreo (7,4).
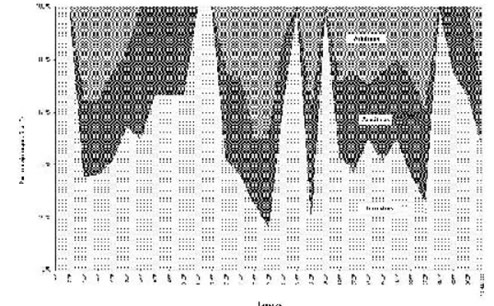
Fig. 8. Proporciones de gremios espaciales de anuros observados en lagunas agrícolas y sitio control.
COMPOSICIÓN DE LA DIETA
En el campo de Córdoba L. latinasus presentó la mayor diversidad trófica (H = 1,2), siguiendo en orden decreciente B. arenarum (H = 1,1) (Tabla 3, Anexo I). Para las especies de Entre Ríos la mayor diversidad trófica (H = 1,25) fue obtenida en L. chaquensis, y la menor en P. albonotatus (H = 0,53) (Tabla 3). Los espectros tróficos resultaron integrados por 31 categorías (1 vegetal y 30 animal) para B. arenarum, seguido por L. chaquensis (21 categorías; 1 vegetal y 20 animal), L. latinasus (16 categorías, 1 vegetal y 15 animal) y P. albonotatus (9 categorías, 1 vegetal y 8 animal). Los artrópodos perjudiciales para los cultivos de soja presentes en la dieta de cada anuro representaron el 78 % en B. arenarum, 48 % en L. chaquensis, 44 % en L. latinasus y 21% en P. albonotatus.
Según los valores de IRI calculados las mayores contribuciones a las dietas, en el campo de Córdoba (Tabla 4a, Anexo I), estarían dadas por coleópteros e isópodos en B. arenarum, y coleópteros y ortópteros en L. latinasus. En el campo de Entre Ríos (Tabla 4b, Anexo I) el IRI fue mayor para coleópteros e himenópteros en L. chaquensis, e himenópteros y coleópteros en P. albonotatus.
Se ilustran con una lámina algunos taxones de anfibios y artrópodos de los cultivos de soja estudiados (Fig. 9).
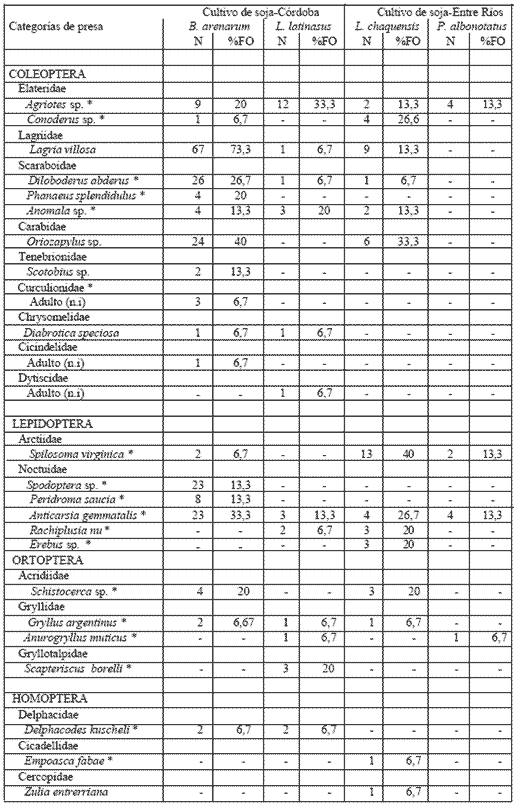
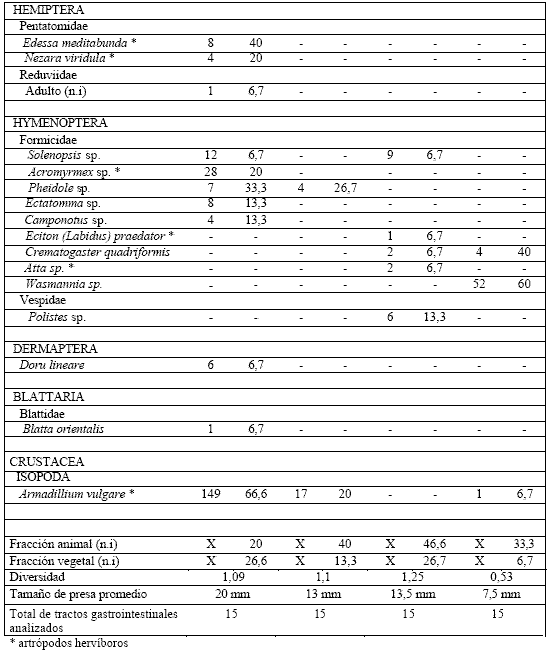
Tabla 3. Composición de la dieta de Bufo arenarum y Leptodactylus latinasus de Córdoba y
L. chaquensis y Physalaemus albonotatus de Entre Ríos. (-) ausente
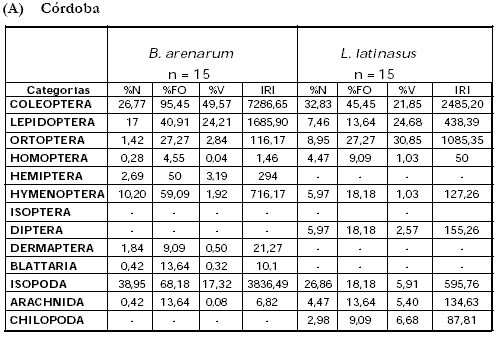
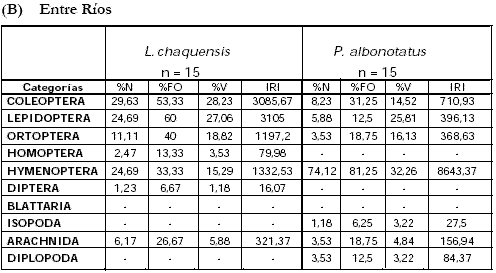
Tabla A y B. Indice de importancia relativa (IRI) de los distintos componentes de la dieta de los anfibios estudiados en los cultivos de soja. A) Córdoba, B) Entre Ríos. (%N) porcentaje numérico; (%FO) porcentaje de ocurrencia; (%V) = porcentaje volumétrico (mm3); (-) ausente.

Fig. 9. Artrópodos plagas y anuros de los cultivos de soja. A. Bufo paracnemis, B. B. fernandezae, C. O. americanus, D. Leptodactylus gracilis, E. L. chaquensis, F. Pseudopaludicola. falcipes. 1. Schistocerca sp., 2. Armadillium vulgare y 3. Piezodorus guildinii
Discusión
DIVERSIDAD DE ANUROS EN LAGUNAS AGRÍCOLAS
La transformación de los ecosistemas tiene como resultado la extinción de especies y la alteración de características ecológicas como la riqueza de especies y su abundancia relativa (Galindo-González et al., 2000). Se ha demostrado que la expansión de los monocultivos agrícolas producen inestabilidad y una disminución en la diversidad de hábitat (Altieri, 1994), y que los sitios más perturbados generalmente tienen una menor riqueza y abundancia de especies de anuros (Bishop et al., 1999; Hazell et al., 2001; Knutson et al., 2004). En concordancia con los autores antes mencionados, en los sitios agrícolas estudiados se observó una disminución del número de especies con hábitos particulares, estando mejor representadas las especies terrestres y semi-acuáticas, respecto de las arbóreas y acuáticas. También se registraron dos especies no forestales (P. albonotatus y P. falcipes) que podrían ser definidas, según Gascon et al. (1999), como especies invasoras de áreas alteradas.
Los resultados del análisis de Componentes Principales y de Correspondencia Canónica mostraron que un incremento en el área y profundidad de las lagunas, ancho del borde del campo, diversidad de la vegetación asociada y temperatura del ambiente fueron las variables locales y espaciales que mejor explicaron el aumento en diversidad y composición de anfibios anuros en las lagunas agrícolas y en el sitio control. Mientras que la proporción de gremios espaciales, entre las lagunas, fue menor de lo esperado al azar, observándose una mayor segregación de especies terrestres. Esto podría deberse a la simplificación de la complejidad estructural de la vegetación y heterogeneidad espacial de los bordes de campo (Maidonneuve y Rioux, 2001).
Es evidente que el/los factor/es que determinan la presencia de anuros en las lagunas son parte de un complejo sistema de relaciones y que se hallan influenciados por situaciones locales (Bishop et al., 1999). Se sugiere que los principales factores reguladores de la diversidad y composición de anuros de las lagunas agrícolas en el centro-oeste de Entre Ríos son factores locales del hábitat, como el área y profundidad de las lagunas, el ancho de borde de los campos, la diversidad de vegetación y cambios en la temperatura del ambiente. Al mismo tiempo, se señala que las lagunas que bordean a los campos de sojas presentan una desigual capacidad para sustentar gremios espaciales de anuros.
ANÁLISIS DE LA DIETA
Los resultados obtenidos demuestran claramente que los anfibios, presentes en los cultivos de soja estudiados, están consumiendo artrópodos, de los cuales, la mayoría son considerados perjudiciales (ej. Nezara viridula, Edessa meditabunda, Agriotes sp., Anomala sp., Diloboderus abderus, Diabotrica speciosa Spilosoma virginica, Anticarsia gemmatalis, Peridroma saucia, Spodoptera sp., Schistocerca sp., Gryllus argentinus, Anurogryllus muticus, Scapteriscus borelli, Acromyrmex spp. y Armadillium vulgare) (Brewer y Arguello, 1980; PIF, 1999; Morrone y Coscarón, 1998; Saini, 2001).
Es de destacar que, la umbría y humedad presente dentro del cultivo de soja, especialmente cuando ésta alcanza cierta altura (> 0,70 cm), sumado a la abundancia de presas propicia la formación de un microclima para que los anuros actúen como efectivos predadores. Del mismo modo, variables locales como la temperatura del ambiente, presencia de cuerpos de agua cercanos y variables espaciales de estructura y composición del paisaje son igualmente importantes en estas poblaciones de anfibios que viven en los cultivos (Attademo et al., 2004; Peltzer et al., 2004 a-b). En conclusión, sugerimos que las especies que habitan en los campos de soja, se comportan como eficientes controladores naturales de artrópodos perjudiciales para los cultivos de soja. Acorde con Altieri (1992), proponemos que el fomento de los enemigos naturales (en este caso los anfibios) y el uso de las tácticas del manejo integrado favorecen a la conservación de la fauna silvestre.
Por último se destaca que, a pesar de la gran carga de agroquímicos que se le aplica a estos cultivos, en los campos muestreados se hallaron importantes poblaciones de anfibios, las que tendrían que continuar siendo estudiadas para evaluar el impacto de la exposición crónica a plaguicidas. Como serían, entre otros, los efectos teratogénicos y las alteraciones hormonales.
MANEJO Y CONSERVACIÓN EN AGRO-ECOSISTEMAS
Un efectivo manejo de las poblaciones de anfibios anuros en paisajes predominantemente agrícolas requiere de un conocimiento de los factores que influyen sobre estas poblaciones (Semlitsch, 2000). En este sentido, la conservación, restauración o creación de ambientes acuáticos en áreas agrícolas deberían ser tenidas en cuenta en planes de manejo para un uso sustentable del recurso. En las áreas de estudio, los ambientes acuáticos relativamente naturales son escasos, suelen están rodeados de la matriz agrícola o estar restringidos a remanentes aislados o humedales, donde no son propicios los cultivo extensivos. De manera que las lagunas agrícolas y su manejo integrado representan importantes alternativas para la reproducción y supervivencia de estos vertebrados.
La preservación de bordes de campo debería considerarse, ya que constituyen elementos del paisaje de gran importancia para la biota local, respecto de la oferta de refugio, conectividad estructural y funcional. Asimismo, estos elementos proveen heterogeneidad espacial, de manera que la simplificación del mismo, desde el punto de vista florístico, o su eliminación contribuyen a la declinación de especies de anuros con hábitos particulares, en nuestro trabajo quedo demostrado con formas que hacen uso de hábitat arbóreos.
Además, este estudio pretende servir de ejemplo demostrativo para justificar la importancia de considerar y conservar los anfibios en los agroecosistemas, como una manera efectiva de aumentar el uso del control biológico. Indudablemente las prácticas agrícolas tendrían que minimizar la utilización de agroquímicos, potencialmente tóxicos para la fauna de anfibios (Izaguirre et al., 2000; Lajmanovich et al., 2003 a-b; Lajmanovich et al., 2004). El uso de plaguicidas puede reducirse por medio de controles biológicos adecuados y prácticas agrícolas tales como la asociación y rotación de cultivos.
Finalmente, un sistema de cultivos más diversificado podría contener ciertos recursos específicos para los enemigos naturales, provistos por la diversidad de plantas en los bordes de campo y heterogeneidad ambiental. Así, la adición de diversidad a los sistemas agrícolas intensivos, podría ejercer cambios en la diversidad del hábitat que favorecerían, en última instancia, a la abundancia de los enemigos naturales y a su efectividad (Altieri, 1992).
Comentarios finales
Teniendo en cuenta la declinación global de anfibios anuros (Blaustein et al., 1994; Storfer, 2003) y considerando como un factor muy importante a la agricultura intensiva (Bishop y Pettit 1992), se sugiere reflexionar y concientizar sobre la aplicación de una agricultura sustentable con la cual no sólo se alcanzaría un rendimiento máximo, sino tambien una estabilidad a largo plazo. En otras palabras, con la agricultura sustentable se lograría una mayor eficiencia en la producción de alimentos y la conservación de recursos naturales, garantizando generacionalmente los mismos sin restricción alguna.
Por otra parte, la preservación a largo plazo de la diversidad requiere de una estrategia de manejo que considere los patrones espaciales y temporales de la biodiversidad regional, tanto como del diseño de agroecosistemas ecológicamente apropiados (Altieri, 1994).
Los principios esbozados en este trabajo son aplicables a cualquier escala, siempre y cuando se trate de incorporar las variables económicas y biológicas en un modelo tecnológico apropiado.
Agradecimientos.
Alfredo Berduc por autorizarnos a trabajar en la reserva de uso múltiple “Parque General San Martín” y por brindarnos constante apoyo. A Guillermo Grosso por permitirnos trabajar en sus cultivos. A Arturo Kehr por sus valiosas orientaciones en estadística. A Germán Peltzer, Andrés Bortoluci y Nicolás Patterer por la invalorable colaboración en los muestreos. A las instituciones que financiaron estos estudios: CONICET, Universidad Nacional del Litoral y SECyT.
Bibliografía
Altieri, M. A. 1987. Agroecology: The scientific basis of alternative agriculture. Westview Press, Boulder.
Altieri, M.A. y Letournerau, D. K. 1982. Vegetation management and biological control in agroecosystems. Crop Protection 1:405-430.
Altieri, M. A. 1991. How best can we use biodiversity in agroecosystems. Outlook on Agriculture 20:15-23.
Altieri, M. A. 1992. Biodiversidad, agroecología y manejo de plagas. CETAL. Santiago de Chile. 162
Altieri, M. A. 1994. Biodiversity and Pest Management in Agroecosystems. Haworth Press, New York.
Aragón, J., Molinari, A. y Lorenzatti, S. 1998. Manejo integrado de plagas. En: L. Giorda, l. y H. Baigorri (eds.), El cultivo de la soja en Argentina. INTA: 247 – 288.
Attademo, A., Peltzer, P. M. y Lajmanovich, R. 2004. Field evaluation of amphibian assemblages in soya croplands in the mid-eastern of Argentina: implication on the biological pest control. Agriculture, Ecosystems and Environment. (En prensa).
Bertonati, C. y Corcuera, J. 2000. Situación ambiental Argentina 2000. Fundación Vida Silvestre Argentina, Buenos Aires, 437pp
Bishop, C.A. y Pettit, K. E. (Eds.). 1992. Declines in Canadian Amphibian Populations: Design a National Monitoring Strategy, Can. Wildl. Serv. Occas. Paper 76, Environment Canada Ottawa.
Bishop, C.A., Mahony, N.A., Struger, J., NG, P. y Pettit, K.E. 1999. Anuran development, density and diversity in relation to agricultural activities in the Holland Riverwatershed, Ontario, Canada (1990-1992). Environmental Monitoring Assessment, 57: 21-43.
Blaustein, A. R., Wake, D. B. y Sousa, W. P. 1994. Amphibian declines: judging stability, persistence, and susceptibility of populations to local and global extinction. Conservation Biology, 8: 60-71
Brewer, M. M. y Arguello, N. V. 1980. Guía ilustrada de los insectos comunes de la Argentina. Fundación Miguel Lillo, Tucumán, Miscelánea, 67: 131 pp
CASAFE, Cámara de Sanidad Agropecuaria y Fertilizantes. 1999. Guía de Productos Fitosanitarios para la República Argentina, Buenos Aires, pp. 343.
Corn, P. S. 1994. Straight-Line Drift Fences and Pitfall Traps: 109-117. En: W. R. Heyer, M. A. Donelly, R. W.
McDiarmid, L. C. Hayek, y M. S. Foster, (eds.), Measuring and monitoring biological diversity: Standard methods for amphibians. Smithsonian Institute Press, Washington, DC. USA
De Bach, P. 1964. The scope of biological control: 3–20. En: DeBach, P. (ed), Biological control of insect pests and weeds. New York: Reinhold.
Dalrymple, G. H. 1988. The herpetofauna of Long Pine Key, Everglades National Park, in relation to vegetation and hydrology: 72-86. En: Szaro, R.; K.E. Severson y D.R. Patton (eds.), Management of Amphibians, Reptiles, and Small Mammals in North America”, U.S.D.A. Forest Service. General Technical Report RM-166. Fort Collins.
Flint, M. L. y Roberts, P. A. 1988. Using crop diversity to manage pest problems: some California examples. Am. Journal of Alternative Agriculture, 3:164-167.
Fowler, C. y Mooney, P. 1990. Shattering: Food, politics and the loss of genetic diversity. Univ. Of Arizona Press. Tucson.
Gascon, C., Lovejoy, T.E., Bierregrad, JR. R.O., Malcolm, J.R., Stouffer, P.C., Vasconcelos H.L., Laurance, W.F., Zimmerman, B., Tocher, M. y Borges, S. 1999. Matrix habitat and species richness in tropical forest remnants. Biological Conservation, 91: 223-229.
Galindo-González, J., Guevara, S. y Sosa, V. J. 2000 Bat- and bird-generated seed rains at isolated trees in pastures in a tropical rainforest. Conservation Biology, 14 (6):1693-1703.
Gotelli, N. J. y Entsminger, G. L. 2001. EcoSim: Null models software for ecology. Version 7.0. Acquired Intelligence Inc. and Kesey-Bear.
Hazell, D., Cunnungham, R., Lindenmayer, D., Mackey, B. y Osborne, W. 2001. Use of farm dams as frog habitat in an Autralian agricultural landscape: factors affecting species richness and distribution. Biological Conservation, 102: 155-169.
Herzog, D. C. y Funderburk, J. E. 1986. Ecological bases for habital management and pest cultural control: 217-250. En: Kogan, M. (ed.), Ecological Theory and Integrated Pest Management Practice. Wiley. NY.
Heyer, W. R., Donelly, M. A., McDiarmid, R. W., Hayek, L. C., y Foster, M. S. 1994. Measuring and monitoring biological diversity: Standard methods for amphibians. Smithsonian Institute Press, Washington, DC. USA.
Hin, C. L. Schenkelaars, P., y Pak, G. A. 2001. Agronomic and environmental impacts of the commercial glyphosate tolerant soybean in the USA. Centre for Agriculture and Environment, Utrecht, 64pp.
Hilje, L. y Hanson, P. 1998. La biodiversidad tropical y el manejo integrado de plagas. Manejo Integrado de Plagas, 48: 1-10.
Hokkanen, H. M. y Pimentel, D. 1989. New associations in biological control: theory and practice. Canad.Entomologist., 121: 829-840.
Hurtubia, J. 1973. Trophic diversity measurement in sympatric predatory species. Ecology, 54: 885-890.
Hutcheson, K. 1970. A test for comparing diversities based on the Shannon formula. Journal of Theoretical Biology, 29: 151-154.
Hyatt, A. y Humphrey, J. 1995. Biological control of the cane toad Bufo marinus in Australia. Froglog, 15: 4.
Izaguirre, M. F, Lajmanovich, R. C., Peltzer, P. M., Peralta soler, A. y Casco, V. H. 2000. Cypermethrin-Induced apoptosis in the telencephalon of Physalaemus biligonigerus tadpoles (Anura: Leptodactylidae). Bulletin of Environmental Contamination and Toxicology, 65: 501-507.
Kippes, R. 2004. Nuestro campo ¿Otro campo?. Conciencia, Año 10 (13): 3-5.
Knutson, M.; Richardson, W., Reineke, D. M, Gray, B. R., Parmelee, J. R. y Weick, S.E. 2004. Agricultural ponds support amphibian population. Ecological Aplications, 14 (3): 669-684.
Lajmanovich, R. C. 1996. Dinámica trófica de juveniles de Leptodactylus ocellatus (Amphibia: Anura), en una isla del Paraná, Argentina. Cuadernos de Herpetología, 10 (1-2): 11-23.
Lajmanovich, R. C. 2000. Interpretación ecológica de una comunidad larvaria de anfibios anuros. Interciencia, 25 (2): 71-79.
Lajmanovich, R.C. y Peltzer, P. M. 2001. Evaluación de la diversidad de anfibios de un remanente forestal del valle aluvial del río Paraná (Entre Ríos- Argentina). Boletín de la Asociación Herpetológica Española, 12: 12-17.
Lajmanovich, R. C., Lorenzatti, E., De La Sierra, P., Marino, F. y Peltzer, P. M. 2002. First Registrations of Organochlorines Pesticides Residues in Amphibians of the Mesopotamic Region, Argentina. Froglog, 54: 4.
Lajmanovich, R., Peltzer, P., Attademo, A., y Cejas, W. 2003. Amphibians in Argentina soybean Croplands: Implication on the Biological Control. Froglog, 59: 2-3.
Lajmanovich, R. C., Sandoval, M. T. y Peltzer, P. M. 2003a. Induction of mortality and malformation in Scinax nasicus tadpoles exposed by Glyphosate formulations. Bulletin of Environmental Contamination and Toxicology, 70 (3): 612-618.
Lajmanovich, R., Lorenzatti, E., Maitre, M. I., Enrique, S. y Peltzer, P. 2003b. Comparative acute toxicity of the commercial herbicides glyphosate to neotropical tadpoles Scinax nasicus (Anura: Hylidae). Fresenious Environmental Bulletin, 12 (4): 364-367.
Lajmanovich, R. C., Sánchez-Hernández, J. C., Stringhini, G. y Peltzer, P. M. 2004. Levels of Serum Cholinesterase Activity in the Rococo Toad (Bufo paracnemis) in Agrosystems of Argentina. Bulletin of Environmental Contamination and Toxicology, 72 (3): 586-591
Lenardón, A. y Enrique, S. 1998. Insecticidas organoclorados en el río Paraná. Natura Neotropicalis, 29(2): 111-116.
Lenardón, R., Lorenzatti, E., Sabattini, R. y Lallana, V. 1999. Contaminantes orgánicos en los suelos y napas freáticas de la provincia de Entre Ríos (Argentina). Natura Neotropicalis, 30 (1-2): 13-17.
Maisonneuve, C. y Rioux, S. 2001. Importance of riparian habitats for small mammal and herpetofaunal communities in agricultural landscapes of southern Québec. Agriculture, Ecosystems and Environment, 83: 165-175.
Magurran, A.E. 1987. Ecological Diversity and its Measurements. Princeton University Press, Princeton, New Jersey.
Morrone, J. J. y Coscarón, S. 1998. Biodiversidad de Artrópodos Argentinos. Una Perspectiva Biotaxonómica. Ediciones SUR, La Plata. 599 pp.
Peltzer, P. M. y Lajmanovich, R. C. 2000. Dieta de Hyla nana (Anura: Hylidae) en charcas temporarias de la llanura aluvial del río Paraná, Argentina. Boletín de la Asociación Herpetológica Española, 11 (2): 71-73.
Peltzer, P. M. y Lajmanovich, R. C. 2002. Foods habits of the green frog Lysapsus limellus (Anura, Pseudidae) in lentic environments of Parana River, Argentina. Bulletin Society Herpetologique France, 101: 53-58.
Peltzer, P., Bock G., Tardivo R. y Lajmanovich R. 2004a. Effects of habitat loss and fragmentation on anuran in Espinal Eco-region of Argentina: a GIS approach. Froglog, 63: 3-4.
Peltzer, P. M., Lajmanovich, R. C, Attademo, M. A. y Beltzer, A. H. 2004b. Anuran diversity across agricultural pond in Argentina. Biodiversity and Conservation (En prensa)
Pinkas, L., Oliphant, M. S. y Iverson, Z. L. 1971. Food habits of albacore bluefin tuna and bonito in California waters. California Ded. Fish Game, Fisheries Bulletin, 152: 1-105.
PIF, 1999. Proyecto de Investigaciones en Fitovirologia. Hoja Informativa. Enfermedades de los cultivos extensivos- intensivos. IFFIVE-INTA, Córdoba, Argentina.
Ringuelet, R. A. 1961. Ecología acuática continental. Eudeba, 138 pp.
Saini, E. D. 2001. Insectos y ácaros perjudiciales al cultivo soja y sus enemigos naturales. Publicación del Instituto de Microbiología y zoología agrícola 4, 89 pp.
Shannon, C. E. y Weaver, W. 1949. The Mathematical Theory of Communications. Univ. of Illinois Press, Urbana.
Semlitsch, R. D. 2000. Principles for management of aquatic-breeding amphibians. Journal of Wildlife Management, 64: 615-631.
Storfer, A. 2003. Amphibian declines: future directions. Diversity and Distributions, 9: 151– 163.
Vallan, D. 2000. Influence of forest fragmentation on amphibian diversity in the nature reserve of Ambohitantely, highland Madagascar. Biological Conservation, 96: 31-43.
Williamson, S. 1998. Understanding natural enemies; a review of training and information in the practical use of biological control. Biocontrol News and Information, 19 (4): 117-126.