Determinación de residuos de organoclorados en vertebrados silvestres del Litoral Fluvial de Argentina
Rafael LAJMANOVICH 1 ; Patricia DE LA SIERRA 2 ; Fernanda MARINO 2 ; Paola PELTZER 3 ; Argelia LENARDÓN 2 y Eduardo LORENZATTI 2
1 Consejo Nacional de Investigaciones Científicas y Técnicas (CONICET). Escuela Superior de Sanidad - Facultad de Bioquímica y Ciencias Biológicas (EES-FBCB-UNL). Pje. El Pozo s/n. (3000) Santa Fe, Argentina. E-mail: lajmanovich@hotmail.comAbstract: RESIDUALS DETERMINATION OF ORGANOCHLORINE PESTICIDES IN WILD VERTEBRATES OF FLUVIAL LITORAL, ARGENTINA.- Concentrations of the organochlorine pesticide were analyzed in fat of amphibians, snakes, birds, and mammals. The specimens were collected from intensively agricultural regions of the Entre Ríos and Santa Fe provinces (Argentina) in 2002-2003. Residues of the organochlorine pesticides chlordane (a + d), endosulfan (a + b), heptachlor, heptachlorepoxide, aldrin and dieldrin were found in the fat samples. Some of them were not in quantified concentrations to be under the limit of detection of the method. The levels of detected residuals do not reach concentrations associated to rapid decreases of wild animals. Nevertheless, we suggest that studies of the affected populations should be continued.
Key words: Pesticides - Organochlorine - Vertebrates - Argentina
Palabras clave: Plaguicidas - Organoclorados - Vertebrados - Argentina
Introducción
Reseña histórica del uso de plaguicidas: El empleo de sustancias químicas inorgánicas para controlar las plagas se remonta a los tiempos de Grecia y Roma; Homero, menciona la utilidad del azufre quemado como fumigante para combatir los insectos. En el siglo XVI, en China, se empleaban pequeñas cantidades arsenicales como agente biocida. Posteriormente, en el siglo XVII apareció el primer insecticida natural; la nicotina, obtenida de los extractos de hoja de tabaco. En 1705, Hamberg, propuso el cloruro de mercurio como preservativo para la madera. Hacia 1850 se introdujeron dos importantes productos naturales: la rotenona y el peritro ambos, aún en la actualidad, ampliamente utilizados. No obstante en 1930, con la aparición de los productos orgánicos sintéticos (ej. tiocianato de alquilo, salicilanilida, dinitro-ortocresol, etc.), comienza la era moderna de los plaguicidas. En 1939 Muller, en Suiza, descubrió las propiedades para el control de plagas del diclorodifeniltricloretano (DDT). En 1945 se introdujeron varios hidrocarburos clorados derivados del ciclodieno, con propiedades insecticidas como el aldrín, dieldrín, heptacloro y endrín. Los compuestos organofosforados representaron otra clase de compuestos orgánicos. El punto de partida para su desarrollo, fueron las investigaciones sobre gases neurotóxicos llevados a cabo en Alemania con el fin de usar dichos gases en la guerra química. En 1950 el malathión fue el primero de los insecticidas de amplio espectro de acción. En 1947, en Suiza, se descubrieron varios tóxicos derivados de los ésteres carbámicos, siendo el más efectivo el carbaril. En los años comprendidos entre 1950-1960 comenzaron a usarse los herbicidas derivados de la urea y aparecieron los fungicidas captan y gliodín. Además, se fabricaron otros nuevos agroquímicos, entre ellos los herbicidas triazínicos y los derivados del amonio cuaternario. En 1958 se introdujeron dos herbicidas de tipo bipiridilo, el diquat y el paraquat. Entre 1960-1965 fueron descriptos el diclobenil, trifluralín y bromoxilino, mientras que en 1968 se introdujo el benomilo como fungicida sistémico. Poco tiempo después apareció el glifosato. Entre los años 1970-1990 surgieron distintos biocidas, basados en mecanismos biológicos, y un nuevo e importante grupo de productos que comprende a los piretroides que originariamente fueron naturales y posteriormente sintetizados a partir de las piretrinas.
Bioacumulación de plaguicidas en la fauna silvestre: En las últimas décadas numerosos autores analizaron los residuos de productos organoclorados en vertebrados terrestres (Culley & Applegate, 1967; Punzo et al. 1979; Alberto & Peña, 1981; Wiktelius & Edwards, 1997; Sparling et al. 2001). En contraste, existe escasa información que documente esta problemática en Sudamérica. En este sentido, Allsopp & Erry (2000), en la recopilación sobre los niveles de contaminantes orgánicos persistentes (COP) en América Latina, no aportaron datos sobre anfibios, reptiles y mamíferos terrestres. Los estudios sobre la acumulación de estos xenobióticos son muy importantes, debido a que es uno de los pocos indicadores que se puede tener sobre la exposición de la fauna silvestre en diferentes lugares y poblaciones (Zakrzewski, 1991). Estas investigaciones son necesarias considerando que el contacto con los plaguicidas, en los animales, se da de manera accidental. Una de las dificultades de monitorear los residuos de estos químicos, es la selección de que compuesto se debe buscar, ya que más de 100 sustancias comprendidas entre organoclorados, organofosforados y carbamatos son registrados como ingredientes activos en miles de productos utilizados como agroquímicos (CASAFE, 2001). Los componentes de mayor importancia para detectar son los compuestos clorados, los cuales tienen un potencial de bioacumulación elevada, afectan la sobrevivencia de las especies y poseen un peligro potencial para la salud humana (OMS, 1982). El descubrimiento de insecticidas organoclorados como el DDT, que son altamente persistentes, bioacumulables y que pueden afectar poblaciones completas de animales silvestres, han generado la prohibición y restricciones en su utilización (Ronald et al. 1990). Aparentemente un plaguicida clorado puede ser encontrado en la fauna y raramente en las personas, debido a la constante exposición a la que están expuestas las especies que habitan en los campos cultivados. No obstante, en la región estudiada, se ha registrado la presencia de residuos de plaguicidas clorados en leche materna (Lenardón et al. 2000). Como la bioacumulación de los organoclorados depende de la cantidad de grasas del organismo, los especímenes adultos pueden tener relativamente bajos niveles de plaguicidas y no presentar signos de intoxicación. Puesto que estos compuestos están almacenados en el tejido adiposo, al movilizar de las reservas grasas durante la reproducción, migraciones, etc. se puede producir la intoxicación de los animales y las crías.
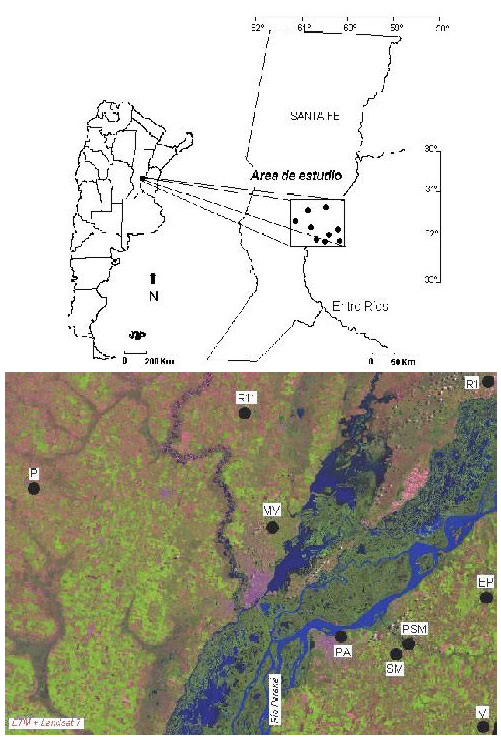
Área donde se realizó el estudio: El trabajo se llevó a cabo en áreas que incluyen a las provincias de Santa Fe y Entre Ríos (República Argentina), (Figura 1). La zona estudiada se encuentra influida por el tramo medio del río Paraná. Esta área es muy compleja desde el punto de vista fitogeográfico, por ser transicional entre las provincias Paranaense, provincia Chaqueña y provincia del Espinal. Siguiendo los criterios de Cabrera (1976) y Burkart et al. (1999), se consideran las siguientes ecoregiones: Chaco Húmedo; Espinal y Selvas Mixtas. Desde hace varias décadas, estas regiones naturales padecen un proceso de constante alteración que consiste, esencialmente, en una disrupción de la continuidad del sistema que genera un paisaje de mosaicos con distintos grados sucesionales. Principalmente, la vegetación nativa ha sido reemplazada y modificada para el uso agropecuario con cultivos extensivos de soja transgénica, ganadería intensiva y de pastoreo, drenaje, introducción y naturalización de especies exóticas (Ligustrum lucidum, Morus alba, Parkinsonia aculeata, Gleditsia triacanthos, Eucaliptus sp. y Pinus sp. entre otras), deforestación (= tala rasa), explotación forestal (=tala selectiva de Prosopis alba, P. algarobilla, P. nigra) y el avance de las metrópolis urbanas. En la región también se registra, en los cinturones urbanos, una intensa actividad hortícola en donde la utilización de fitosanitarios es muy intensa. Los cultivos extensivos más importantes de la zona son soja, trigo, maíz, sorgo, alfalfa y trébol, para los cuales se requieren productos fitosanitarios que se reemplazan a través de los años, acorde a las prohibiciones legales (CASAFE, 2001). En lo que respecta a los organoclorados, su uso fue muy difundido en la Argentina hace dos décadas (Lenardón et al. 1994), posteriormente fueron paulatinamente sustituidos por piretroides (CASAFE 2001), a excepción del endosulfán un organoclorado de amplia difusión y permanente uso ya que se aplica a cultivos de soja convencional y transgénica (Lorenzatti et al. 2004).
Diversos trabajos han verificado el impacto de los sistemas agrícolas sobre la fauna regional de vertebrados (ej. Canavelli et al. 2004; Lajmanovich et al. 2004; Peltzer et al. 2003; 2004) de igual forma, se ha detectado la presencia de residuos de plaguicidas en especies silvestres (Lenardón & Enrique, 1998; Lajmanovich et al. 2002). Por estos antecedentes, se plantea un estudio sobre las consecuencias no deseadas del uso de biocidas, brindándose registros de bases relativos a la presencia de residuos de compuestos organoclorados en anfibios, serpientes, aves y mamíferos que habitan en áreas con intensa explotación agraria, útiles para futuros planes de manejo y conservación de la región.
Materiales y Métodos
Las muestras de tejidos examinadas provienen, en su mayoría, de animales que se encontraron atropellados en rutas y caminos que recorren localidades con intensa explotación agropecuaria. La metodología empleada se utilizó para no sacrificar especimenes que habitan en sitios altamente impactados por los sistemas agrícolas (Maxell & Hokit, 1999). Todos los individuos colectados estaban en buen estado de conservación, factor importante para que no exista alteración en la concentración de organoclorados originalmente presentes en sus tejidos (Borrell & Aguilar, 1990). Se obtuvo un total de 19 muestras en 8 puntos, que cubren un área aproximada de 37.000 km2 (Figura 1), en la provincia de Entre Ríos: (PA) Paraná (31 º 42´ S; 60 º 30´ O), (EP) El Palenque (31º 31 ´S; 60º 10 ´O), (V) Viale (31º 50´ S; 60º 7´ O), (PMS) Parque San Martín (31º 40´ S; 60º 30´ O) y (SM) Sauce Montrul (31º 44´ S; 60º 18´ O) y en la provincia de Santa Fe: (MV) Monte Vera (31 º 32´ S; 60 º 41´O), (P) Pilar (31º 27´S; 60º 55´O), (R1) Ruta 1 (31º 38´ S;60º 40´ O) y (R11) Ruta 11 (31º 16´ S;60º 46´ O), (Tabla 1). De cada ejemplar se extrajeron muestras de tejido graso (± 20 g), que inmediatamente fueron trasladadas al laboratorio y procesadas de acuerdo a la técnica de la Food Safety and Inspection Service (IDF, 1978). Esta metodología consiste en una extracción de los analitos de interés con solvente orgánico y una coextracción de otras sustancias solubles. Posteriormente, y como herramienta previa al análisis cromatográfico, se realizó una serie de limpiezas o proceso de eliminación de compuestos que pudieran interferir en el análisis. Para lo cual se utilizó columna de alúmina neutra y se efectuó la elución con éter de petróleo. Las condiciones del material de vidrio y calidad de reactivos son descriptas en Maitre et al. (1994). Se buscó identificar y cuantificar, por cromatografía gaseosa, residuos de los plaguicidas: a, b y g HCH, aldrín, p,p-DDT, p,p-DDE, p,p-DDD, heptacloro y su epóxido, a y g clordano, a y b endosulfán, dieldrín y endrín. El equipo utilizado fue un cromatógrafo VARIAN 3400 con detector de captura electrónica y columna capilar DB-608 (30 m x 0.25 mm I.D., 1.5 mm). Las condiciones operativas fueron: temperatura de inyector 240°C, temperatura de detector 320°C y temperatura de columna 220°C. La técnica analítica tuvo un porcentaje de recuperación entre el 87 y 102 %, mientras el límite de detección fue de 2 ng/g. Las muestras fueron analizadas por triplicado y además se trabajó con muestras sembradas con estándares certificados (Applid Science 99,2% de pureza). Se operó en el modo de inyección automático "splitless", introduciendo un volumen de 1ul en cada análisis.

Fig. 1. Localización de los sítios de muestreo.
Imagen ETM+ Landsat 7 (composición color 3-4-5, resolución
espacial 30 m).
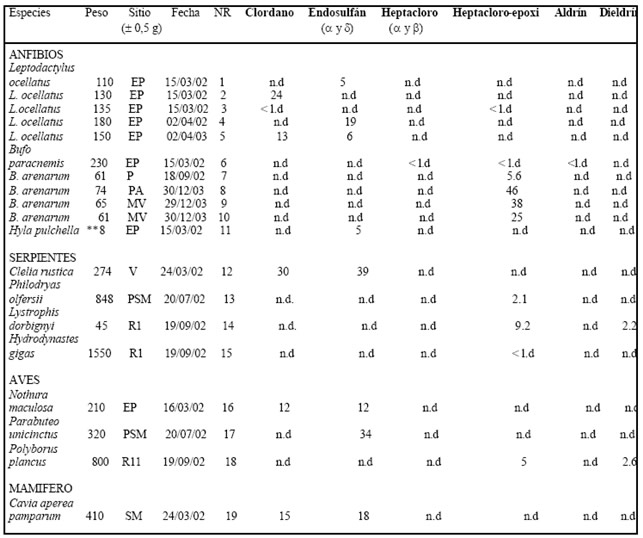
Tabla 1. Residuos de organoclorados detectados en tejidos de vertebrados silvestres de las provincias de Entre Ríos y Santa Fe (Argentina). (PA) Paraná (EP) El Palenque, (V) Viale, (PSM) Parque San Martín, (SM) Sauce Montrul,ç (MV) Monte Vera, (P) Pilar, (R1) Ruta 1 y (R11) Ruta 11. (NR) Número De Referencia.
Los especímenes empleados para este estudio fueron depositados en el Instituto Nacional de Limnología (INALI) y en el Museo de Ciencias Naturales de Entre Ríos (MER), con los siguientes números de referencia: 1: INALI-PL604, 2: INALI-PL614, 3: INALI-PL762, 4: INALI-PL763, 5: INALI-PL774, 6: INALI-PL 921, 7-10: INALI-PL 922-5, 11: no ingresado, 12: INALI-A1011, 13: INALI-A1244, 14: INALI-A1287, 15: no ingresado, 16: MER-5276, 17: MER-5282, 18: MER-5277 y 19: MER-5278.
Resultados y Discusión
En la Tabla 1 se detallan las concentraciones de plaguicidas halladas en tejidos grasos de anfibios, reptiles, aves y mamíferos colectados en las provincias de Entre Ríos y Santa Fe. Todos los residuos hallados corresponden a productos organoclorados; en estos, su estructura química y la presencia de átomos de cloro explican su alta estabilidad y persistencia ambiental (Zakrzewski, 1991). Además, su liposolubilidad les confiere un medio favorable para su conservación y acumulación facilitando los procesos de traslocación a través de las redes tróficas. Productos como el DDT, dieldrín y endrín persisten por años y son un peligro potencial para los ecosistemas (Kuhr et al. 1974; Allsopp & Erry, 2000; Wiktelius & Edwards, 1997).
Cuando los organismos no blanco se ponen en contacto con plaguicidas, pueden sufrir un envenenamiento agudo que les produce la muerte. En el caso de los compuestos clorados, más lipofilicos, residuos del compuesto inicial o de sus metabolitos tienden a acumularse en el tejido adiposo. Una de las vías más probable de entrada de los plaguicidas clorados es la dieta, y especialmente a través de las partes más grasa de los alimentos, ya que debido a la alta lipofilia de estos plaguicidas, el organismo los absorbe más rápidamente desde el tracto digestivo cuando están disueltos en grasa. Asimismo, estos xenobióticos se acumulan en plantas oleosas y en otros tegumentos de los vegetales y la fauna silvestre también puede estar expuesta por la ingestión de sus frutos o de las plantas mismas.
Como se explicó anteriormente, los biocidas clorados son los más persistentes, los organofosforados y carbamatos son de duración media, que oscila entre días a meses, en contraste los piretroides y algunos agentes de control biológico como las feromonas e inhibidores de quitina son los menor vida media. Kearney & Helling (1969) agruparon las clases de plaguicidas en tres categorías basadas en su permanencia en el ambiente. Según el tiempo de persistencia, señalaron el tiempo requerido para desaparecer el material en un 75% del lugar de aplicación. En esta clasificación, los no persistentes tienen valores entre 1 y 12 semanas, los moderadamente persistentes de 1 a 18 meses y los persistentes, como los organoclorados, de 2 a 5 años.
Los residuos encontrados en este trabajo han sido hallados por otros autores en disímiles concentraciones. Por ejemplo, Bonin et al. (1995) determinaron 0,2-4,7 ng/g de clordano en anfibios y reptiles; en este estudio, el rango del clordano (12-24 ng/g) fue aparentemente mayor. Punzo et al. (1979) y Bonin et al. (1995) reportaron, respectivamente, 26 y 2,2 ng/g de heptacloro en anfibios y reptiles, mientras que Fasola et al. (1998) cuantificaron 90 ng/g de aldrín en aves. Heptacloro y aldrín, que son de frecuente aparición en muestras ambientales (Allsopp et al. 1998), no fueron determinados en este estudio excepto en niveles no cuantificables. Sin embargo, el metabolito del primero, heptacloro-epoxi se detectó en el 52,6 % muestras analizadas (Tabla 1). El endosulfán, con un rango de 5-39 ng/g, se halló en el 42,1 % de los animales evaluados. Este hecho se podría explicar porque en el área estudiada los cultivos de soja son la principal explotación agropecuaria (Arregui, 2001) y el endosulfán se utiliza en forma masiva para el control de algunas de sus plagas (CASAFE, 2001).
Es importante subrayar que para el clordano, endosulfán y dieldín existen evidencias de su efecto estrogénico (Soto et al. 1994; Arnold et al. 1997). En California (Estados Unidos), Sparling et al. (2001), hallaron residuos de endosulfán en más del 86 % de las poblaciones de anfibios evaluadas. En tanto que Park et al. (2001) demostraron que los niveles bajos de endosulfán (5 ppb) interfieren en los mecanismos ferohormonales de anfibios urodelos. Efecto biológicamente significante con concentraciones menores a las permitidas, como residuos, en el agua dulce superficial para el normal desarrollo de la vida acuática (valor de referencia del Canadian Water Quality Guidelines (0,02 ppm) (CWQG, 1987), y casi mil veces menor a lo permitido por la EPA (0,1-2 ppm) como residuo de endosulfán en alimentos (Park et al. 2001). También queremos destacar, que de acuerdo a la hipótesis de Sower et al. (2000), el incremento en la tasa de malformaciones en anuros puede deberse a la acción de disruptores endocrinos y que Ouellet et al.(1997) reportaron una mayor frecuencia de ranas malformadas, en poblaciones de sitios agrícolas expuestas a organoclorados como el DDT (Cooke, 1973). De igual forma, estos químicos con actividad estrogénica, están implicados en disfuncionesreproductivas y anormalidades en el desarrollo de numerosas especies, que incluyen peces y reptiles(Crain & Guillette, 1997). Además, en humanos están señalados como potenciales factores etiológicos en el incremento de casos de cáncer y alteraciones de fertilidad (Carlsen et al. 1995; Wolff & Toniolo, 1995).
Nuestros resultados indican la presencia de un variado espectro de residuos clorados en especies no directamente relacionadas, ni provenientes del mismo sitio, situación que permite suponer que el fenómeno puede alcanzar a gran parte de la comunidad. En principio, podemos afirmar que los residuos de plaguicidas hallados se distribuyen en forma uniforme en la matriz ambiental estudiada.
Más aún, las concentraciones observadas en algunos consumidores superiores (ej. Clelia rustica y Parabuteo unicinctus) podrían evidenciar procesos de biomagnificación. Además, cabe señalar que los organoclorados heptacloro, aldrín y dieldrín son de uso restringido desde el año 1968 y de prohibición total, excepto para salud pública, desde 1995. Para el clordano se dictó su prohibición total en 1998 (SENASA, 1998).
Según los niveles de residuos detectados, ninguno de los compuestos alcanza concentraciones asociadas a mortalidades masivas de animales silvestres, aunque resulta evidente que, en cualquier caso, la simple existencia de este tipo de xenobióticos ejerce, como señala Odum (1972), una presión sobre el flujo de energía del ecosistema. Del mismo modo, sugerimos que la apreciación del verdadero alcance de los resultados obtenidos requiere de un seguimiento de los niveles de contaminantes y de la evolución de las poblaciones afectadas, de la misma forma que la posible relación de las sustancias estrogénicas advertidas, con el registro de anfibios malformados en la región (Peltzer et al. 2001; Attademo el al. 2004) y con otras especies de vertebrados propuestas como centinelas (Stoker et al. 2002). Asimismo, tal como se refieren Altieri & Rojas (1999), se pone de manifiesto que la expansión de los sistemas agrícolas producen efectos ecológicos no deseados.
Agradecimientos
A Esteban Lavilla por la lectura crítica del manuscrito, y a Vanesa Arzamendia, Alfedro Berduc, Andrés Bortoluci, Alejandro Giraudo y Norberto Muzzachiodi por la colecta de ejemplares e información aportada.
Bibliografía
Alberto, L. y Peña, J. 1981. Niveles de contaminantes organoclorados y metales pesados en huevos de aves de las Marismas del Guadalquivir, 1975. Doñana Acta Vetebrata 8: 206-206.
Allsopp, M. Stringer, R y Johnston, P. 1998. Persistent Organochlorines in Humans. Greenpeace Laboratories, Dept. Biological Sciences. University of Exeter. Principe of Road, Exeter EX4 4PS, UK.
Allsopp, M. y Erry, B. 2000. COPs en América Latina. Una revisión de los niveles de los contaminantes orgánicos persistentes en América Latina. Universidad de Exeter, Exeter, Reino Unido, 73 pp.
Altieri, M. y Rojas, A. 1999. Ecological impacts of Chile’s neoliberal policies, with special emphasis on agroecosystems. Environment, Development and Sustainability 1: 55-72.
Arnold, S. Vonier, P. Collins, B. Klotz, D. Guillette, L. y Mclachlan, J. 1997. In vitro synergistic interaction of alligator and human estrogen receptors with combinations of environmental chemicals. Environmental Health Perspective 105: 615-618.
Arregui, M. 2001. Manejo de agroquímicos en cultivos extensivos. Universidad Nacional del Litoral, Santa Fe, Argentina. 205 pp.
Attademo, A.M. Peltzer, P.M. y Lajmanovich R. C. 2004. Nuevo caso de malformación en un ejemplar de rana (Leptodactylus ocellatus)(Amphibia: Anura) del litoral argentino. Boletín de la Asociación Herpetológica Española 15:20-22
Bonin, J. Desgranges, J. Bishop, C. Rodrique, J. Gendron, A. y Elliott, J. 1995. Comparative study of contaminants in the mudpuppy (Amphibia) & the common snapping turtle (Reptilia), St. Lawrence River, Canada. Archives of Environmental Contamination and Toxicology 28: 184-194.
Borrell, A. y Aguilar, A. 1990. Loss of organochlorine compounds in the tissues of a decomposing stranded dolphin. Bulletin of Environmental Contamination and Toxicolology 45: 53-56.
Burkart, R. Bárbaro, N. Sanchez, R.O. y Gómez, D. 1999. Eco-Regiones de la Argentina. Administración de Parques Nacionales (Ed.), Buenos Aires
Cabrera, A.L. 1976. Regiones fitogeográficas argentinas. Enciclopedia Argentina de Agricultura y Jardinería 2 (1): 1-85.
Canavelli, S. Zaccagnini, M.E. Torresin, J. Calamari, N. Ducommun M.P. y Capllonch P. 2004. Monitoreo Extensivo de Aves en el Centro-Sur de Entre Ríos. Pp: 349-362. En: Temas de la Biodiversidad del Litoral Fluvial Argentino. INSUGEO, Miscelánea. Tucumán.
Carlsen, E. Giwercman, A. Keiding, N. y Skakkebaek, N.E. 1995. Declining semen quality and increasing incidence of testicular cancer: is there a common cause? Environ Health Perspect 103: 137-139.
CASAFE 2001. Guía de productos fitosanitarios 2001. Cámara de Sanidad Agropecuaria y Fertilizantes. 9 edición, Buenos Aires, Argentina,1660 pp.
Cooke, A.S. 1973. Response of Rana temporaria tadpoles to chronic doses of p’p´-DDT. Copeia 4: 647-652.
Crain, D.A. y Guillette, L.J. 1997. Endocrine-disrupting contaminants and reproduction in vertebrate wildlife. Rev Toxicol 1:47-70.
Culley, D. y Applegate, H. 1967. Insecticide concentrations in wildlife at Presidio, Texas. Pesticide Monitoring Journal 1: 21-28.
CWQG 1987. Canadian Water Quality Guidelines. Canadian Council of Ministers of the Environment Task Force on Water Quality Guidelines. Environment Canada. Ottawa, Ontario. Canada; 6 Chapters plus XXII Appendices.
Fasola, M. Movalli, A. y Gandini, C. 1998. Heavy metal, organochlorine pesticide, and PCB residues in eggs and feathers of herons breeding in northern Italy. Archives of Environmental Contamination and Toxicology 34: 87-93.
IDF 1978. International Alumina column for the determination of clorinated hydrocarbons in fatty foods. Provisional International Dairy Federation. Standard 75ª. Food Safety and Inspection Service (USDA).
Kearney, H.W. y Helling, C.S. 1969. Reaction of pesticides in soils. Residues Rev. 25: 25-44.
Kuhr, R.J. Davis, A.C. y Bourke, J.B. 1974. DDT residues in soil, water and fauna from New York apple orchards. Pestic.Monit.J. 7(3/4): 200-204.
Lajmanovich, R. Lorenzatti, E. De La Sierra, P. Marino, F. y Peltzer, P. 2002. First Registrations of Organochlorines Pesticides Residues in Amphibians of the Mesopotamic Region, Argentina. Froglog 54: 4.
Lajmanovich, R. Sánchez-Hernández, J.C. Stringhini, G. y Peltzer, P. 2004. Levels of Serum Cholinesterase Activity in the Rococo Toad (Bufo paracnemis) in Agrosystems of Argentina. Bulletin of Environmental Contamination and Toxicology 72: 586-591.
Lenardón, A. y Enrique S. 1998. Insecticidas organoclorados en el río Paraná. Natura Neotropicalis 29 (2): 111-116.
Lenardón, A. Maitre, M. Fusé, J. Nochetto, C. y Depetris, P. 1994. Organochlorine and Organophosphorous Pesticides in the Paraná River. Argentine. Science of the Total Environment 34: 289-297.
Lenardón, A. Maitre, M.I. Lorenzatti, E. y Enrique, S. 2000. Plaguicidas organoclorados en Leche Materna en Santa Fe, Argentina. Acta Toxicológica Argentina 8 (1): 2-4.
Lorenzatti, E, Altahus, R. Lajmanovich, R. y Peltzer, P. 2004. Residues of Endosulfan in Soy Plants in Argentina Croplands. Fresenious Environmental Bulletin 13: 89-92.
Maitre, M. De La Sierra, P. Lenardón, A. Enrique, S. y Marino, F. 1994. Pesticide Residue Levels in Argentinean Pasteurized Milk. Science of the Total Environment 155: 105-108.
Maxell, B. y Hokit, D. 1999. Amphibians and Reptiles. Pages 2.1-2.29 in G. Joslin and H. Youmans, coordinators. Effects of recreation on Rocky Mountain wildlife: A Review for Montana. Committee on Effects of Recreation on Wildlife, Montana Chapter of The Wildlife Society, 307 pp.
Odum, E.P. 1972. Ecología. Interamericana. México, 479 pp.
OMS 1982. DDT y sus derivados. Criterios de Salud Ambienta. Organización Mundial de la Salud, Ginebra.
Ouellet, M. Bonin, J. Rodriguez, J. DesGranges, J.L. Lair, S. 1997. Hindlimb deformities (ectromelia, ectrodactyly) in freeliving anurans from agricultural habitats. J Wildl. Dis. 33: 95-104.
Park, D. Hempleman, S. y Propper, C. 2001. Endosulfan Exposure Disrupts Pheromonal Systems in the Red- Spotted Newt: A Mechanism for Subtle Effects of Environmental Chemicals. Environmental Health Perspectives 109: 669-673.
Peltzer, P. M., M. L. Ponssa y R. C. Lajmanovich. 2001. Caso de malformación en Leptodactylus mystacinus (Anura: Leptodactylidae). Natura Neotropicalis. 32 (2): 173-176.
Peltzer, P. Lajmanovich, R. y Beltzer, A. 2003. The effects of habitat fragmentation on amphibian species richness in the floodplain of the middle Paraná River. Herpetological Journal 13: 95-98.
Peltzer, P.M. Lajmanovich, R.C. Attademo, M.A. y Beltzer, A.H. 2004. Anuran diversity across agricultural pond in Argentina. Biodiversity and Conservation (en prensa)
Punzo, F. Laveglia, J. Lohr, D. y Dahm, P. 1979. Organochlorine insecticide residues in amphibians and reptiles from Iowa and lizards from the southwestern United States. Bulletin of Environmental Contamination and Toxicology 21: 842-848.
Ronald, J. Kendall, J. Funsch, M. y Bens, M. 1990. Use of wildlife for on-site evaluation of bioavailability and ecotoxicity of toxic substances found in hazardous waste sites. In: In situ Evaluations of Biological Hazards of Environmental Pollutants. Edited by S. S. Sandhu. Plenum Press, New York. SENASA 1998. Servicio Nacional de Sanidad y Calidad Agroalimentaria. Resolución 513/98.
Soto, A.M., Chung, K.L. y Sonnenschein, C. 1994. The pesticides endosulfan, toxaphene, and dieldrin have estrogenic effects on human estrogen-sensitive cells. Environmental Health Perspectives 102: 380-383.
Sower, S.A. Reed, K.L. y Babbitt, K.J. 2000. Limb Malformations and Abnormal Sex Hormone Concentrations in Frogs. Environmental Health Perspectives 108: 1085-1090.
Sparling, D. Fellers, G. y Mcconnell, L. 2001. Pesticides and amphibian populations declines in California, USA. Environmental Toxicology and Chemistry 20: 1591-1595.
Stoker, C. Bussmann, L. Siroski, P. Larriera, A. Munoz de Toro M.M. y Luque E.H. 2002. Evaluation of Caiman latirostris as a sentinel of environmental contamination with xenoestrogens. Biocell 26: (1).
Wiktelius, S. y Edwards, C. 1997. Organochlorine Insecticide Residues in African Fauna: 1971-1995. Reviews of Environmental Contamination and Toxicology 151: 1-37.
Wolff, M.S. y Toniolo, P.G. 1995. Environmental organochlorine exposure as a potential etiologic factor in breast cancer. Environ. Health. Perspect. 103 (suppl 7): 141-145.
Zakrzewski, S. F. 1991. Principles of Environmental Toxicology. ACS, Washington.