Biodiversidad de Cyanophyceae (Cyanobacteria) y especies toxigénicas del litoral fluvial argentino
Yolanda ZALOCAR de DOMITROVIC1,2 y Marina E. FORASTIER21Centro de Ecología Aplicada del Litoral (CONICET), C.C. 291, 3400-Corrientes, E-mail: yzalocar@arnet.com.ar
2Cátedra de Ficología (Departamento de Biología), Facultad de Ciencias Exactas y Naturales y Agrimensura
(UNNE), Av. Libertad 5600, 3400-Corrientes.
Abstract: BIODIVERSITY OF CYANOPHYCEAE (CYANOBACTERIA) OF THE ARGENTINIAN FLUVIAL LITTORAL. This paper summarizes the data available about the diversity of blue-green algae (Cyanobacteria) from Corrientes, Chaco, Formosa, Misiones, Entre Ríos, Santa Fe provinces, Paraná and Paraguay rivers from published and unpublished dates. It includes a compilation of 158 taxa distributed in 48 genera. Some aspects of abundance, waterbloom production and toxigenic species are emphasized.
Key words: Cyanophyceae (Cyanobacteria) - biodiversity - toxigenic species - fluvial littoral - Argentina.
Palabras clave: Cyanophyceae (Cyanobacteria) - biodiversidad - especies toxigénicas - litoral fluvial - Argentina.Introducción
Las cianofíceas, de organización celular procariota, son organismos microscópicos predominantemente dulceacuícolas, con muy pocos representantes marinos. Componen la fracción vegetal del plancton (fitoplancton) e integran comunidades del fondo (fitobentos) y del perifiton en la zona litoral de ambientes leníticos y lóticos. Están representadas por formas unicelulares, coloniales, filamentosas y pseudoparenquimáticas. Las formas coloniales suelen formar agregados macroscópicos de 2 a 10 mm aproximadamente.
Entre sus pigmentos fotosintéticos presentan ficobiliproteínas con predominio de ficocianinas (o ficoeritrinas) que enmascaran el color verde de la clorofila a1 y le confieren un característico tono azulado motivo por el que tradicionalmente se las denominó comúnmente algas azules o verdeazuladas.
Tienen su óptimo desarrollo en ambientes alcalinos o salinos y suelen estar ausentes en aguas ácidas con pH inferior a 4. Generalmente son termofílicas, y algunas especies están adaptadas a vivir a temperaturas tan altas como 70-73ºC, lo que generalmente ocurre en fuentes de agua termal.
Las formas planctónicas generalmente poseen aerótopos (vesículas de gas o "pseudovacuolas") en sus células, mediante las cuales pueden controlar su flotabilidad y también su posición en la columna de agua de acuerdo a sus requerimientos fisiológicos. Algunas especies, además de aerótopos, poseen heterocitos, los que participan en la fijación del Nitrógeno atmosférico.
Se reproducen asexualmente mediante la formación de hormogonios, endosporas o exósporas o se propagan vegetativamente por fragmentación de las colonias y/o filamentos. Algunas formas filamentosas (Nostocales y Stigonematales) producen acinetos, es decir estructuras de resistencia que les permite sobrevivir ante condiciones ambientales desfavorables.
En ambientes eutróficos con alto contenido en nutrientes (principalmente N y P), el crecimiento explosivo de algas produce discoloración del agua, fenómeno conocido como floración o "waterbloom". Algunas especies (particularmente aquellas que contienen aerótopos en sus células) suelen formar acumulaciones o costras superficiales. Las floraciones ocurren tanto en ambientes leníticos como lóticos. En estos últimos son menos frecuentes y están restringidas a las zonas de la costa o de remansos. La presencia de estas floraciones desmejora notablemente la calidad del agua para consumo y fines recreativos. Para que ocurra una floración de cianobacterias, deben darse ciertas condiciones ambientales específicas tales como altas temperaturas (entre 15 y 30 ºC) pH entre 6 y 9 (o más elevado), moderada a elevada concentración de nutrientes, viento moderado o ausente; también baja turbulencia y velocidad del agua, insolación alta y morfometría favorable del cuerpo de agua (Reynolds y Walsby, 1975; Reynolds, 1984). En represas, estos factores asociados a un largo tiempo de permanencia del agua favorece el desarrollo de floraciones (Tundisi, 1990).
En aguas continentales, son varios los grupos de algas que poseen especies tóxicas (Bacillariophyceae, Dinophyceae, Cryptophyceae), pero es el grupo de las algas azules (Cyanophyceae o Cyanobacteria) el que contiene el mayor número de especies toxigénicas. La mayoría son representantes planctónicos siendo potencialmente tóxicas las especies productoras de floraciones, y dentro de éstas son extremadamente tóxicas las especies que son fijadoras de Nitrógeno.
Una gran variedad de cianobacterias producen uno o más tipos de toxinas que pueden tener efectos nocivos sobre los organismos. A nivel mundial se han mencionado numerosos casos de mortandad de ganado, aves y animales silvestres en general, provocado por la ingesta directa de algas. En los peces, además, la muerte puede producirse indirectamente por las condiciones de anoxia generadas en el cuerpo de agua durante la descomposición de las algas.
Las toxinas (o cianotoxinas) son metabolitos secundarios producidos en el interior de las células y liberados al agua al producirse la lisis o destrucción de la pared celular, los que tienen efectos nocivos o perjudiciales sobre otras células, tejidos u organismos. Un aspecto preocupante es que las toxinas liberadas al agua no se eliminan con el tratamiento convencional de potabilización del agua (floculación, filtración y cloración) y la remosión de las toxinas sólo son eficientes mediante tratamientos con carbón activado y ozonización (Carmichael y Falconer, 1993; Chorus y Bartram, 1999).
En la literatura se describen dos tipos básicos de toxinas: hepatotoxinas y neurotoxinas, las que se clasifican de acuerdo a la estructura química y localización de la acción en los organismos vivos. Las hepatotoxinas (péptidos cíclicos) causan necrosis de los hepatocitos con destrucción del endotelio sinusoidal seguido de hemorragia hepática y shock hipobolémico. En bajas concentraciones, incorporadas durante mucho tiempo, tienen un efecto crónico, promoviendo la formación de tumores hepáticos. Las neurotoxinas son alcaloides que actúan bloqueando la transmisión neuromuscular y la muerte sobreviene por parálisis de los músculos respiratorios (Carmichael, 1992; Chorus y Bartram, 1999).
Las más difundidas son las especies productoras de hepatotoxinas con representantes de los géneros Microcystis, Anabaena, Nodularia, Oscillatoria, Nostoc, Hapalosiphon, Coelosphaerium, Cylindrospermopsis, Gloeotrichia, Lyngbya, Tolypothrix y Anabaenopsis, las que son responsables de la mayor parte de casos de intoxicación en el mundo. Las neurotoxinas (de acción más rápida) están menos extendidas que las hepatotoxinas y son producidas por especies y cepas de Anabaena, Aphanizomenon, Oscillatoria, Raphidiopsis y Trichodesmium.
Si bien la muerte de animales asociadas a floraciones de cianofíceas (Nodularia spumigena) data de 1878 (Carmichael, 1994), la estructura química de las primeras toxinas fueron identificadas recién a principios de la década del 70 y desde entonces se continúan descubriendo nuevas toxinas y/o variantes de éstas, mediante sofisticadas técnicas de aislamiento e identificación. Paralelamente se han producido importantes avances en el estudio de la biología molecular y de sus efectos sobre los organismos. La mayor parte de estas investigaciones fueron desarrolladas en países del hemisferio norte (Europa, Estados Unidos, Asia, Australia). Estos aspectos son poco conocidos e incluso ignorados en América del Sur.
Actualmente hay un interés generalizado por la problemática de las "algas tóxicas azules" debido al creciente incremento de floraciones asociadas a procesos de eutrofización. Un ejemplo son las recientes floraciones de Microcystis aeruginosa ocurridas en el verano de 2004, en el Río de La Plata (INA, 2004) y en el río Paraná, desde la represa de Yacyretá y 230 km aguas abajo de la misma, en el curso del río (CECOAL, 2004).
En nuestro país son escasas o faltan las investigaciones básicas y estudios de toxicidad en áreas relacionadas a floraciones de algas (Pizzolon et al., 1999). La falta de laboratorios y equipos especializados, causa dificultades para el desarrollo de investigaciones de toxicidad y por lo tanto, de las posibles consecuencias para el ambiente y la salud pública. En el LFA (Litoral Fluvial Argentino) hay referencias de floraciones de diferentes especies de cianofíceas únicamente para las provincias de Santa Fe (Apesteguía et al., 1974; García de Emiliani, 1978; García de Emiliani y Emiliani, 1997), Misiones (Meichtry de Zaburlín, 1994) y Corrientes (Asselborn et al., 1998; Zalocar de Domitrovic, 1998, 2003b).
Al estudiar un cuerpo de agua es importante tomar conocimiento de las especies de cianofíceas que contiene y para ello se necesita conocer no solamente su determinación taxonómica, sino también la abundancia en que se presentan, si son productoras o no de floraciones y si éstas son potencialmente tóxicas. Estos aspectos deben tenerse en cuenta para realizar estudios de toxicidad y tomar medidas de prevención y/o control. Puesto que la escasa información disponible para el LFA se encuentra dispersa en trabajos (publicados e inéditos) de orientación taxonómica y ecológica (éstos incluyen listas de especies del fitoplancton), en esta contribución se presenta un inventario de las especies de cianofíceas registradas por diferentes autores para el LFA en ambientes de las provincias de Corrientes, Chaco, Formosa, Misiones, Entre Ríos, Santa Fe y en los ríos Paraná y Paraguay. Se incluye además, un resumen de los aspectos más relevantes de este grupo de algas (ahora cianobacterias) relacionados a su abundancia, diversidad y toxicidad.
Estado actual de la taxonomía de Cyanophyceae
Actualmente existen dos taxonomías para las algas azules. Inicialmente fueron clasificadas como Cyanophyta de acuerdo al Código Internacional de Nomenclatura Botánica. Este sistema de clasificación tradicional, de acuerdo a la concepción de Geitler (1932), se basa fundamentalmente en caracteres morfológicos y citológicos de especímenes procedentes de hábitats naturales. Según este sistema de clasificación, la división Cyanophyta contiene aproximadamente 150 géneros y unas 2000 especies.
La actual taxonomía bacteriológica resumida en la octava edición del Manual de Bacteriología Sistemática de Bergey (Buchanam y Gibbons, 1974), se basa en caracteres bioquímicos y fisiológicos de los organismos mediante su crecimiento en cultivos axénicos. Actualmente esto representa sólo una pequeña proporción de especies en relación a las más de 2000 especies descriptas.
Una moderna revisión en la taxonomía botánica de algas azules está en vigencia y después de muchas disputas y controversias iniciales, ambas taxonomías se encuentran ahora en una convergencia constructiva.
En la práctica la mayoría de los ficólogos identifican a este grupo a partir de muestras obtenidas de su hábitat natural basándose en caracteres morfológicos de las células, colonias y/o filamentos como así también en el tipo de reproducción. Este sistema de identificación taxonómica, basado en Geitler (1932) y Desikachary (1959) fue utilizado en este trabajo para la ubicación de los taxones registrados para el LFA por diferentes autores, siguiendo la reciente clasificación propuesta por Anagnostidis y Komárek (1985, 1988, 1990) y Komárek y Anagnostidis (1986, 1989).
Estado actual del conocimiento de las Cyanophyceae del Litoral
Los estudios de Cyanophyceae realizados para el LFA son escasos y fragmentarios. El único trabajo taxonómico sobre las Cyanophyceae del NEA fue publicado por Tell (1994). Algunas especies de este grupo fueron tratadas en trabajos sobre la ficoflora de las provincias de Formosa (Tracanna y Lacoste, 1998) y Entre Ríos (Lacoste, 1961, Lacoste et al., 1986, 1987) los que incluyen un área reducida y escasa frecuencia de muestreos. El resto de los taxones registrados para este grupo para las provincias de Corrientes, Chaco, Santa Fe, Misiones y para los ríos Paraná y Paraguay figura en inventarios de trabajos ecológicos referidos al fitoplancton (García de Emiliani, 1978, 1979, 1980, 1981, 1990, 1993-1994, 1997; García de Emiliani y Anselmi de Manavella, 1989; Absi y Meichtry de Zaburlín, 1985, 1987; Meichtry de Zaburlín, 1994, 2002; Zalocar de Domitrovic, 1990, 1992, 1993, 1999, 2002, 2003a,b; Zalocar de Domitrovic y Vallejos, 1982; Zalocar de Domitrovic et al., 1986, 1997(1998), 1998).
Diversidad y abundancia de Cyanophyceae
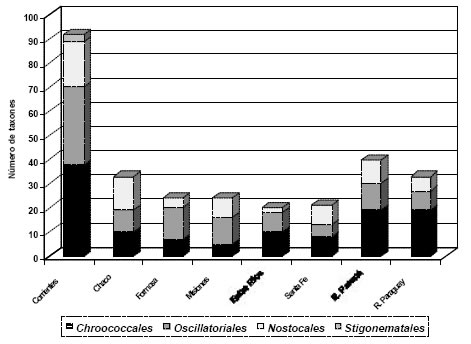
El mayor número de especies de Cyanophyceae fue registrado para la provincia de Corrientes con 92 taxones y dentro de esta, la mayor diversidad la presenta el sistema del Iberá (Zalocar de Domitrovic, 2003b). Le siguen en orden de importancia las provincias de Formosa (24), Misiones (24), Chaco (23), Entre Ríos (23) y Santa Fe (21). Teniendo en cuenta los grandes ríos, el río Paraná registró un mayor número de especies que el río Paraguay, con 40 y 33, respectivamente (Figura 1).

Fig. 1. Número de taxones registrados en los cuatro Ordenes taxonómicos de Cyanophyceae para las provincias de Corrientes, Chaco, Formosa, Misiones, Entre Ríos y Santa Fe, ríos Paraná y Paraguay.
En la Tabla 1 se detallan los taxones de Cyanophyceae para cada Orden taxonómico hallados en el LFA por diferentes autores. El Orden Chroococcales cuenta con el mayor número de especies, seguido en importancia por Oscillatoriales, Nostocales y Stigonematales. Una excepción la constituyen las provincias de Formosa, Misiones y Entre Ríos, en las que el mayor número de especies fue señalado para Oscillatoriales (Figura 1). Esto probablemente esté en relación al método de muestreo, y al tratarse de trabajos taxonómicos, para Formosa (Tracanna y Lacoste, 1988) y Entre Ríos (Lacoste, 1961, Lacoste et al. 1986, 1987), las autoras incluyen también, además del plancton, especies ticoplanctónicas, es decir provenientes de otras comunidades.
El número de especies total y para cada una de las provincias seguramente es mayor al señalado en la Tabla 1. Esto está relacionado fundamentalmente al esfuerzo e intensidad de muestreos, a la experiencia en taxonomía y a los métodos de recuento utilizados (teniendo en cuenta que algunas especies son difíciles de identificar en cámaras de recuento). Las provincias de Formosa, Misiones y Entre Ríos, por ejemplo, cuentan con un escaso número de muestreos, en relación a la provincia de Corrientes y al río Paraná, que hasta ahora son los más estudiados.
Los 158 taxones infragenéricos registrados en el LFA se hallan distribuídos en 48 géneros comprendidos
en cuatro de los principales Ordenes de amplia distribución mundial:
Orden Chroococcales: Contiene formas unicelulares y coloniales. Las colonias son regulares
o irregulares, con escasas o numerosas células incluídas en vainas mucilaginosas. Los agregados
de células pueden formar filamentos ramificados o no, unidos en un pseudoparénquima. En
el LFA se registraron 57 taxones distribuídos en 14 géneros.
Orden Oscillatoriales: Incluye algas azules filamentosas, frecuentemente uniseriadas, y si hay
ramificaciones éstas son falsas. Se reproducen mediante formación de hormogonios y no
forman acinetos ni heterocitos. Se registraron 20 géneros y 59 taxones infragenéricos. Junto con
las Chroococcales son los mejor representados en el LFA por la amplia variedad de especies que
contienen.
Orden Nostocales: incluye formas filamentosas que también se reproducen por hormogonios,
pero hay formación de acinetos y heterocitos. Este es el grupo mejor representado en el LFA
por la alta densidad poblacional en la que se presentan, muchos de ellos productores de
floraciones (Anabaena spiroides, Cylindrospermopsis raciborskii, Aphanizomenon flos-aquae, Nodularia
spumigena, Raphidiopsis mediterranea, R. curvata, Anabaenopsis arnoldii y A. circularis). Representado
por 39 especies distribuídas en 13 géneros.
Orden Stigonematales: contiene formas filamentosas frecuentemente multiseriadas con ramificaciones
verdaderas y formación de hormogonios, acinetos y heterocitos. No tiene representantes
en el plancton y sólo fue registrado un único género (Hapalosiphon), con 3 especies
para la provincia de Corrientes.
La abundancia de este grupo es muy variable según las características limnológicas de los ambientes (temperatura, pH, presencia o ausencia de vegetación acuática, tipo de vegetación, concentración de nutrientes, etc.). En la Figura 2 se representa la abundancia de Cyanophyceae en relación a los demás grupos que integran el fitoplancton, para ambientes de las provincias de Corrientes y Chaco y los ríos Paraná y Paraguay. Estos estudios se basan en valores promedio de densidad (referidos a ind. ml-1) utilizando el mismo método de recuento (Utermöhl, 1958) obtenidos en estudios anteriores (Zalocar de Domitrovic, 1992, 1993, 1999, 2002, 2003 a,b; Zalocar de Domitrovic et al., 1997(1998), 1998; Asselborn et al., 1998). Para las demás provincias no hay datos disponibles de abundancia.
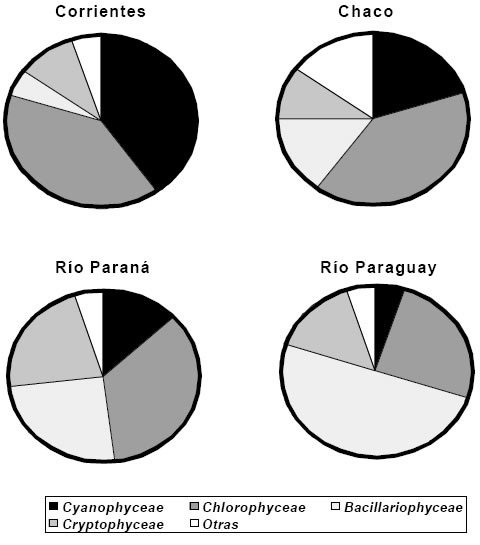
Fig. 2. Proporción relativa de la abundancia de Cyanophyceae (en color negro) en relación a los demás grupos taxonómicos del fitoplancton basados en valores de densidad (ind. ml-1).
En general hay mayor desarrollo de cianofíceas en cuerpos de agua de la provincia de Corrientes que en el Chaco. En la primera son más frecuentes en ambientes leníticos no vegetados o con escasa vegetación acuática, donde producen floraciones, particularmente en primavera y verano. Las especies más abundantes se encuentran entre las Nostocales seguida en orden de importancia numérica por Oscillatoriales y Chroococcales (Figura 3).
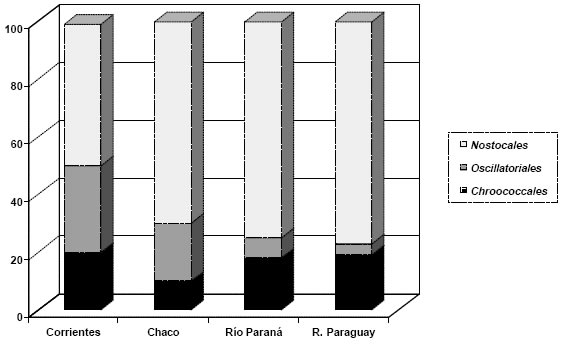
Fig. 3. Porcentaje de contribución de los principales Ordenes taxonómicos de Cyanophyceae, basados en datos de abundancia (ind. ml-1) para las provincias de Corrientes, Chaco, ríos Paraná y Paraguay.
Un ejemplo característico son las lagunas del NO de la provincia de Corrientes, donde ocurren floraciones de Microcystis aeruginosa (Figs. 4 y 6 A-B), Anabaena spiroides (Figs. 5 y 6 J,M), Cylindrospermopsis raciborskii (Fig. 6 G-I), Raphidiopsis curvata (Fig. 6 D) y Raphidiopsis mediterranea (Fig. 6 F). Las tres últimas especies suelen encontrarse en alta densidad junto a Planktolyngbya contorta (Fig. 6 C) y P. subtilis (Fig. 6 E) en las lagunas del extremo norte del sistema Iberá, tales como las lagunas Galarza, Luna e Iberá (Zalocar de Domitrovic, 2003b).
En la provincia del Chaco, a diferencia de Corrientes, las floraciones de algas azules son menos frecuentes (representadas además por un menor número de especies). Los ambientes estudiados poseen características limnológicas diferentes a los de la provincia de Corrientes y a los del Chaco oriental (planicie de inundación Paraguay-Paraná) y, generalmente presentan una densa cobertura de vegetación flotante con dominancia de Eichhornia crassipes. Esta especie vegetal inhibiría la producción algal por efectos de sombreado y absorción de nutrientes. En ambientes no vegetados y de elevada conductividad suelen registrarse especies adaptadas a condiciones de alta salinidad, las que ocasionalmente suelen formar floraciones tales como Anabaenopsis circularis (Fig. 6 K), A. arnoldii (Fig. 6 L) y Nodularia spumigena (Fig. 6 N), especies registradas también en la provincia de Santa Fe en ambientes de alta conductividad. Nodularia spumigena fue citada también para Entre Ríos (Lacoste et al., 1987), pero no hay datos ambientales del lugar donde fue encontrada.
En los ríos Paraná y Paraguay la densidad de Cyanophyceae es baja en relación a la registrada en ambientes leníticos de las provincias del LFA. En general, el río Paraná presenta mayor abundancia de Cyanophyceae que el río Paraguay. Esto estaría relacionado al elevado número de embalses que presenta el río Paraná asociados a un incremento de la eutrofización en la alta cuenca. En el río Paraguay, si bien el número de muestreos es menor que en el anterior, la baja densidad de cianofíceas registrada hasta ahora probablemente estaría relacionada a un escaso grado de intervención antrópica en la cuenca, sumado al hecho de que presenta un mayor desarrollo de humedales en sus cabeceras (Zalocar de Domitrovic, 1999, 2002). La abundancia de este grupo en los ríos (al igual que los demás componentes del fitoplancton) está inversamente relacionada con la altura hidrométrica.
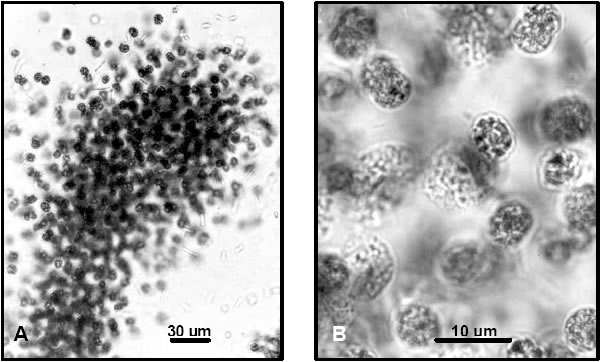
Fig. 4. Microcystis aeruginosa Kütz. A: Aspecto parcial de una colonia (400x), B: Detalle de un grupo de células, donde se observan los aerótopos o “pseudovacuolas” (1000x).
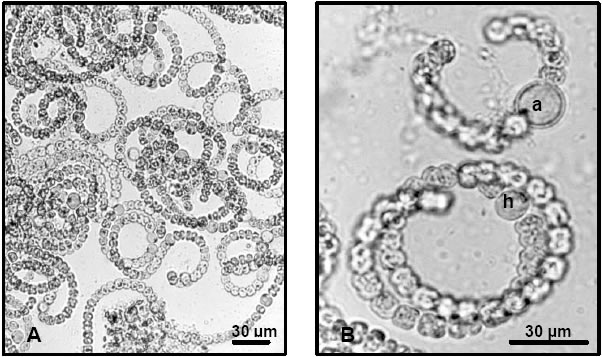
Fig. 5. Anabaena spiroides Kleb. A: aspecto general de un grupo de filamentos (160x), B: Detalle de dos filamentos donde se observa un acineto (a) y un heterocito en formación (h) (400x).
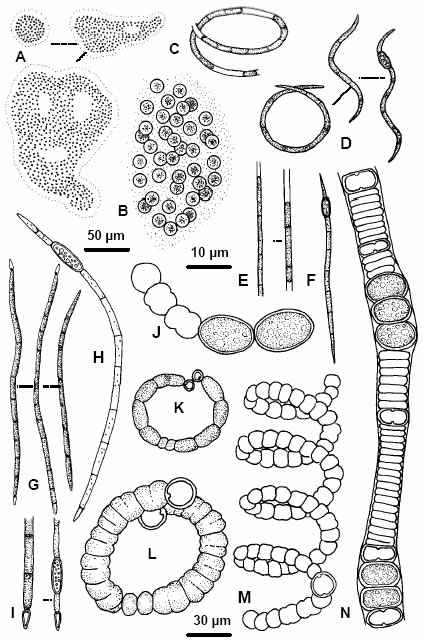
Fig. 6. A-B: Microcystis aeruginosa, C: Planktolyngbya contorta, D: Raphidiopsis curvata, E: Planktolyngbya subtilis, F: Raphidiopsis mediterranea, G-I: Cylindrospermopsis raciborskii, K: Anabaenopsis circularis, L: A. arnoldii, J, M: Anabaena spiroides, N: Nodularia spumigena.
Cyanophyceae tóxicas o especies toxigénicas
Un importante número de especies han sido señaladas en la bibliografía mundial como productoras de diferentes tipos de toxinas (Carmichael y Falconer, 1993; Skulberg et al., 1993; Lahti, 1997; Namikoshi et al., 2003). En el LFA, el 12% de las especies halladas hasta ahora son potencialmente tóxicas (19 taxones señalados en la Tabla 1 con un asterisco). El mayor número de especies tóxicas se encuentra en representantes del Orden Nostocales: Anabaena spiroides, Cylindrospermopsis raciborskii, Raphidiopsis curvata, Raphidiopsis mediterranea, Aphanizomenon flos-aquae y Nodularia spumigena. Otra especie frecuente es Microcystis aeruginosa (Chroococcales) la cual produce floraciones en las lagunas del NO de Corrientes, particularmente aquellas cuyas playas son utilizadas como balnearios (Zalocar de Domitrovic et al., 1997(1998), 1998; Asselborn et al., 1998), y últimamente, en el verano de 2004, se encontró en altas concentraciones en el río Paraná entre Ituzaingó y Corrientes, en este último sobre la margen izquierda (Zalocar de Domitrovic, obs. pers.).
Consideraciones finales
A escala global, uno de los problemas de calidad de agua más extendido es el incremento progresivo de la eutrofización de los ambientes acuáticos. Sus efectos producen cambios en la composición taxonómica y abundancia del fitoplancton. Aumenta la frecuencia y densidad de floraciones y las cianofíceas desplazan a los demás grupos de algas interfiriendo significativamente en la malla trófica y en el uso y calidad estética del cuerpo de agua.
Un componente integral en programas de monitoreo de fuentes de agua y caracterización del ecosistema es el recuento e identificación taxonómica del fitoplancton con el fin de detectar anticipadamente posibles floraciones de cianobacterias. Este grupo merece especial atención cuando está integrado por especies potencialmente tóxicas. Si bien un análisis microscópico no nos permite reconocer la toxicidad de las cepas (una misma especie puede tener cepas tóxicas y no tóxicas), una correcta determinación taxonómica es importante para conocer si estamos en presencia o no de una especie toxigénica. Además, es necesario conocer la densidad celular de cada especie (expresada como células/mililitro), lo cual es utilizado como uno de los indicadores alertas (o niveles de vigilancia) que permiten advertir del potencial riesgo toxicológico (Chorus y Bartram, 1999). Los valores indicativos para los niveles de vigilancia se basan en el número de células por mililitro de cianofíceas (o de biomasa expresada como biovolumen o concentración de clorofila a) y que superados determinados valores, debe realizarse la detección y determinación de toxinas. El monitoreo de estos organismos (y de sus toxinas) en las fuentes de agua y sistemas de distribución son esenciales para determinar medidas de control y un manejo apropiado de la cuenca.
En el inventario de especies proporcionado para el LFA, de las 158 especies señaladas, 19 especies (12%) son potencialmente tóxicas, y la mayoría de ellas producen floraciones. Es importante realizar análisis de toxicidad para estas especies del LFA, particularmente durante los eventos de floraciones para detectar si efectivamente son tóxicas y adoptar así medidas de prevención y/o control, particularmente en ambientes cuyas playas son utilizadas como balnearios (lagunas del NO de Corrientes) y/o como fuente de agua para consumo (río Paraná) de los que hasta la fecha no se cuenta con determinaciones cualitativas y cuantitativas de toxicidad.
Bibliografía
Absi, S. y Meichtry de Zaburlín, N.R. 1985. Ficoflora de la provincia de Misiones (Argentina) I. Desmidiales (Chlorophyta) (1). Historia Natural 5 (29): 245-265.
Absi, S. y Meichtry de Zaburlín, N.R. 1987. Fitoplancton de los tributarios del río Alto Paraná. I. Primeros datos de los arroyos Yabebiry, Santa Ana y San Juan, provincia de Misiones (Argentina). Boletín de la Sociedad Argentina de Botánica 25 (1-2): 43-57.
Anagnostidis, K. y Komárek, J. 1985. Modern approach to the classification system of cyanophytes 1-Introduction. Archiv für Hydrobiologie/Supplementband 71, Algological Studies 38/39: 291-302.
Anagnostidis, K. y Komárek, J. 1988. Modern approach to the classification system of cyanophytes. 3- Oscillatoriales. Archiv für Hydrobiologie/Supplementband 80, Algological Studies 50-53: 327-472.
Anagnostidis, K. y Komárek, J. 1990. Modern approach to the classification system of cyanophytes. 5- Stigonematales. Archiv für Hydrobiologie/Supplementband 86, Algological Studies 59: 1-73.
Apesteguía, C., Marta, J.M. y García de Emiliani, M.O. 1974. Floración acuática de algas verdes-azules en el “Lago del Parque Belgrano” (Santa Fe). Temas de Sanidad 1 (2): 29-49.
Asselborn, V.M., Zalocar de Domitrovic, Y. y Casco, S.L. 1998. Estructura y variaciones del fitoplancton de la laguna Soto (Corrientes, Argentina). Boletín de la Sociedad Argentina de Botánica 33 (3-4):17-27.
Buchanan, R.E. y Gibbons, N.E. 1974. Bergey’s manual of determinative bacteriology. 8th ed. Williams and Wilkins, Baltimore, USA, 1246 p.
Carmichael, W.W. 1992. Cyanobacteria secondary metablites-the cyanotoxins. Journal of Applied Bacteriology 72: 445-449.
Carmichael, W.W. 1994. Toxinas de cianobacterias. Investigación y Ciencia 210: 22-29.
Carmichael, W.W. y Falconer, I.R. 1993. Diseases related to freshwater blue-green algal toxins, and control measures. En: Falconer I.R. (ed.), Algal toxins in seafood and drinking water. Academic Press Ltd, London, pp 187-209.
CECOAL (Centro de Ecología Aplicada del Litoral), 2004. Preocupación por la calidad de las aguas del río Paraná. Entrevista a investigadores del CECOAL, por Lara Neiff. Diario El Libertador: 13, 09-03-2004.
Chorus, I. y Bartram, J. (eds.) 1999. Toxic Cyanobacteria in water. A guide to their public health consequences, monitoring and management. WHO. E & FN Spon, London, 416 p.
Desikachary, T.V. 1959. Cyanophyta. I.C.A.R. Monographs on Algae, New Delhi, 686 p.
García de Emiliani, M.O. 1978. Ciclo anual del fitoplancton en el Lago del Parque General Belgrano (Santa Fe, Argentina). Ecología 3: 73-80.
García de Emiliani, M.O. 1979. Campaña “Keratella I” a lo largo del río Paraná Medio. III. Fitoplancton de ambientes leníticos. Revista de la Asociación de Ciencias Naturales del Litoral 10: 73-84.
García de Emiliani, M.O. 1980. Fitoplancton de una laguna del valle aluvial del Paraná Medio (“Los Matadores”, Santa Fé, Argentina). I. Estructura y distribución en relación a factores ambientales. Ecología 4: 127-140.
García de Emiliani, M.O. 1981. Fitoplancton de los principales cauces y tributarios del valle aluvial del río Paraná: tramo Goya-Diamante. Revista de la Asociación de Ciencias Naturales del Litoral 12: 112-125.
García de Emiliani, M.O. 1990. Variaciones diarias del fitoplancton (laguna “El Tigre”, llanura aluvial del Paraná Medio, Argentina). Revista de la Asociación de Ciencias Naturales del Litoral 21 (1): 49-60.
García de Emiliani, M.O. 1993-1994. Fitoplancton y características ambientales de un arroyo contaminado (Arroyo San Lorenzo, Santa Fe, Argentina). Revista de la Asociación de Ciencias Naturales del Litoral 24-25: 57-64.
García de Emiliani, M.O. 1997. Effects of water level fluctuations on phytoplankton in a river-floodplain lake system (Paraná river, Argentina). Hydrobiologia 357: 1-15.
García de Emiliani, M.O. y Anselmi de Manavella, M.I. 1989. Fitoplancton y variables ambientales en la cuenca del río Saladillo (Santa Fe, Argentina). Revista Brasileira de Biología 49 (4): 957-967.
García de Emiliani, M.O. y Emiliani, F. 1997. Mortandad de ganado y aves silvestres asociada con una floración de Anabaena spiroides Kleb. Natura Neotropicalis 28 (2): 150-157.
Geitler, L. 1932. Cyanophyceae. En: Rabenhorst (ed.), Kryptogamen-Flora, Leipzig 14: 1-1196.
INA (Instituto Nacional del Agua), 2004. Río de La Plata: alarma por la presencia de algas tóxicas en ls tomas de agua. Informe del INA. Diario Hoy.net, La Plata, 04-03-2004.
Komárek, J. y Anagnostidis, K. 1986. Modern approach to the classification system of cyanophytes. 2- Chroococcales. Archiv für Hydrobiologie/Supplementband 73, Algological Studies 43: 157-226.
Komárek, J. y Anagnostidis, K. 1989. Modern approach to the classification system of cyanophytes. 4- Nostocales. Archiv für Hydrobiologie/Supplementband 82, Algological Studies 56: 247-345.
Lacoste, E.N. 1961. Fitoplancton de Ibicuy (Entre Ríos). Darwiniana 12 (2): 191-202. Lacoste, E.N., Vigna, M.S., Maidana, N.I. y Mac Carthy, S. 1986. Algas de aguas continentales de Argentina. V. Entre Ríos I. Darwiniana 27 (1-4): 107-141.
Lacoste, E.N., Vigna, M.S., Mac Carthy, S. y Maidana, N.I. 1987. Algas de aguas continentales de Argentina. VII. Entre Rios II. Darwiniana 28 (1-4): 105-145.
Lahti, K. 1997. Cyanobacterial hepatotoxins and drinking water supplies – aspects of monitoring and potential health risks. Monographs of the Boreal Environment Research 4: 1-40.
Meichtry de Zaburlín, N.R. 1994. Fitoplancton del embalse del arroyo Urugua-í. Misiones, Argentina. Tankay (Argentina) 1: 60-61.
Meichtry de Zaburlín, N.R. 2002. Estructura de la comunidad fitoplanctónica en el embalse Yacyretá (Argentina-Paraguay), Tesis de MsC, Facultad de Humanidades y Ciencias, Universidad Nacional del Litoral, Santa Fe, 127 p.
Namikoshi, M., Murakami, T., Watanabe, M.F., Oda, T., Yamada, J., Tsu Nagai, H. y Oishi, S. 2003. Simultaneous production of homoanatoxin-a, anatoxin-a, an non-toxic 4-hydroxyhomoanatoxin-a by the cyanobacterium Raphidiopsis mediterranea Skuja. Toxicon 42 (5): 533-538.
O´Farrell, I., Izaguirre, I. y Vinocur, A. 1996. Phytoplankton ecology of the Lower Paraná River (Argentina). Archiv für Hydrobiologie/Supplementband 115/1, Large Rivers 11 (1): 75-89.
O´Farrell, I., Vinocur, A. y Lombardo, R.J. 1998. Cross-channel and vertical variation in diversity and abundance of phytoplankton in the lower Paraná River, Argentina. Archiv für Hydrobiologie/Supplementband 115/2, Large Rivers 11 (2): 103-123.
Pizarro, H.N. 1991. Algas nuevas o interesantes asociadas a vegetación acuática de ambientes leníticos de la provincia de Corrientes (Argentina). Boletín de la Sociedad Argentina de Botánica 27 (1-2): 31-35.
Pizzolon, L. 1996. Importancia de las cianobacterias como factor de toxicidad en las aguas continentales. Interciencia 21 (6): 239-245.
Pizzolon, L., Tracanna, B., Prósperi, C. y Guerrero, R. 1999. Cyanobacterial blooms in Argentinean inland waters. Lakes & Reservoirs: Research and Management 4: 1-5.
Reynolds, C.S. 1984. The ecology of freshwater phytoplankton. Cambridge University Press, Cambridge, 384 p.
Reynolds, C.S. y Walsby, A.E. 1975. Water-blooms. Biological Reviews of the Cambridge Philosophical Society 50: 437-481.
Skulberg, O.M., Carmichael, W.W., Codd, G.A. y Skulberg, R. 1993. Taxonomy of Toxic Cyanophyceae (Cyanobacteria). En: Falconer I.R. (ed.), Algal toxins in seafood and drinking water. Academic Press Ltd, London, pp. 145-164.
Tell, G. 1985. Catálogo de las algas de agua dulce de la República Argentina. Bibliotheca Phycologica 70, Cramer, Germmany, 283 p.
Tell, G. 1994. Planktonic Cyanophyceae from northeastern Argentina. Revue d’Hydrobiologie tropical 27 (4): 347-360.
Tracanna, B.C. y Lacoste, E.N. 1988. Algas de aguas continentales de la Argentina, IX. Ficoflora de Formosa. Lilloa 37 (1): 61-93.
Tundisi, J.G. 1990. Distribuição espacial, seqüência temporal e ciclo sazonal do fitoplâncton em represas: fatores limitantes e controladores. Revista Brasileira de Biología 50 (4): 937-955.
Utermöhl, H. 1958. Zur Vervollkommnung der quantitativen Phytoplankton-Methodik. Mitteilungen der Internationale Vereinigung für Theoretische und Angewandte Limnologie 9: 1-38.
Zalocar de Domitrovic, Y., 1990. Efecto de las fluctuaciones del nivel hidrométrico sobre el fitoplancton en tres lagunas isleñas en el área de confluencia de los ríos Paraná y Paraguay. Ecosur 16 (27): 13-29.
Zalocar de Domitrovic, Y., 1992. Fitoplancton de ambientes inundables del río Paraná (Argentina). Estudio comparativo entre áreas libres y vegetadas. Revue d’Hydrobiologie tropical 25 (3): 177-188.
Zalocar de Domitrovic, Y., 1993. Fitoplancton de una laguna vegetada por Eichhornia crassipes en el valle de inundación del río Paraná (Argentina). Ambiente Subtropical 3: 39-67.
Zalocar de Domitrovic, Y. 1999. Estructura y dinámica del fitoplancton en la cuenca del eje potámico Paraguay-Paraná (Argentina). Tesis Doctoral, Universidad Nacional de Córdoba, Córdoba, 375 p.
Zalocar de Domitrovic, Y. 2002. Structure and variation of the Paraguay River phytoplankton in two periods of its hydrological cycle. Hydrobiologia 472:177-196.
Zalocar de Domitrovic, Y. 2003a. Effect of fluctations in water level on phytoplankton development in three lakes of the Parana river floodplain (Argentina). Hydrobiologia 510: 175-193.
Zalocar de Domitrovic, Y. 2003b. Fitoplancton de lagunas y cursos de agua del sistema Iberá. En: Poi de Neiff, A.S.G. (ed.), Limnologia del Iberá: Características físicas, químicas y biológicas de las aguas. Eudene, Corrientes, pp 85-142.
Zalocar de Domitrovic, Y., Asselborn, V.M. y Casco, S.L. 1998. Variaciones espaciales y temporales del fitoplancton en un lago subtropical de Argentina. Revista Brasileira de Biología 58 (3):359-382.
Zalocar de Domitrovic, Y., Bonetto, C.A. y Lancelle, H.G. 1981. Algunos aspectos limnológicos de la laguna Herradura (Formosa, Argentina). Ecosur 8 (15): 171-188.
Zalocar de Domitrovic, Y., Casco, S.L. y Asselborn, V.M. 1997(1998). Estudio de la biomasa y diversidad de fitoplancton de la laguna Paiva, Corrientes, Argentina. Physis (Buenos Aires), Sección B 55 (128-129):1-13.
Zalocar de Domitrovic, Y. y Forastier, M.E. Nuevos aportes al conocimiento de Cyanophyceae (Cyanobacteria) del Litoral Fluvial Argentino (en preparación).
Zalocar de Domitrovic, Y. y Vallejos, E.R. 1982. Fitoplancton del río Alto Paraná. Variación estacional y distribución en relación a factores ambientales. Ecosur 9 (17): 1-28.
Zalocar de Domitrovic, Y., Vallejos, E.R. y Pizarro, H.N. 1986. Aspectos ecológicos de la ficoflora de ambientes acuáticos del Chaco Oriental (Argentina). Ambiente Subtropical 1: 92-111.